
����Ŀ���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)��
2CO2(g)+N2(g)��
��1������һ���¶��£���1.0molNO��0.5molCO����0.5L�̶��ݻ��������У��ﵽƽ��ʱNO��CO��CO2��N2���ʵ����ֱ�Ϊ��0.8mol��0.3mol��0.2mol��0.1mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ���������¶Ȳ��䣬���������г���CO��N2��0.3mol��ƽ�⽫ �ƶ�������������ҡ���������
��2��CO���Ժϳɼ״�����֪��
��2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ��H=��1529kJ��mol��1��
��2CO(g)+O2(g)=2CO2(g) ��H=��566.0kJ��mol��1��
��2H2(g)+O2(g)=2H2O(l) ��H=��571.6kJ��mol��1��
��CO(g)+2H2(g)![]() CH3OH(g) ��H= kJ��mol��1��
CH3OH(g) ��H= kJ��mol��1��
���𰸡���1��K=5/144��0.0347 ����2����90.1
��������
�����������1�����������Ϊ0.5L��ƽ��ʱNO��CO��CO2��N2���ʵ����ֱ�Ϊ��0.8mol��0.3mol��0.2mol��0.1mol����÷�Ӧ�Ļ�ѧƽ�ⳣ��K=��0.4��0.4��0.2���£�1.6��1.6��0.6��0.6��=0.0347��Q=��0.4��0.4��0.8���£�1.6��1.6��1.2��1.2��=0.0347��ƽ�ⲻ�ƶ���
��2�����ݸ�˹���ɣ��ڡ�1/2+��-�١�1/2����H=-566.0/2-571.6+1529/2=��90.1 kJ��mol��1��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҩ������ҽѧ��Խ��Խ�ܵ���ע����ҩҩ����˪����Ҫ�ɷ�As2O3�����������Ƽ���Ѫ����Ϊ�ˣ��鼰�仯�������ȡ�ٴ������ע��
��1��As��ԭ�ӽṹʾ��ͼΪ![]() �����������ڱ��е�λ����_____________��
�����������ڱ��е�λ����_____________��
��2��NԪ�طǽ����Ա�Asǿ������˵����ȷ����_______��
��NH3�����ȶ��Ա�AsH3��
��HNO3�����Ա�H3AsO4ǿ
��N��ԭ�Ӱ뾶��As��ԭ�Ӱ뾶С
��3��������ͼд��As2O5�ֽ�ΪAs2O3���Ȼ�ѧ����ʽ____________________��
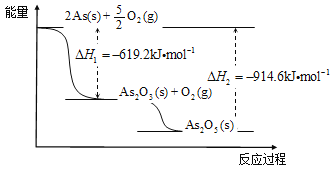
��4��������֪�����Դ����飨As2S3����������ȡAs2O3����ȡ�Ĺ������̼�ͼ���£�
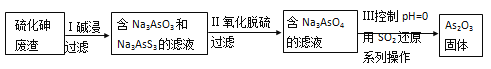
�� As2S3��Na3AsS3�е�S��Ϊ-2�ۣ���������з����ķ�Ӧ________��ѡ��������������������������ԭ��Ӧ��
�����˲������õIJ���������_________________________��
��д�������������ӷ���ʽ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��һ����Ҫ�Ļ���ԭ�������й��Ʊ�;����������ͼ��ʾ������˵������ȷ������ ��
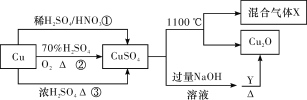
A��;�������û�����H2SO4��HNO3���ʵ���֮�����Ϊ3��2
B�������;����������;�������õ���������ɫ��ѧ˼��
C��1 mol CuSO4��1100 �����û������X��O2Ϊ0.75 mol
D��Y������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ձ�����������ƿ�����������Թ�����ƿ���������þƾ��Ƽ���ʱ������Ҫ��ʯ�������ǣ� ��
A. �ڢܢ� B. �ڢܢ� C. �ܢޢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ԫ�����ڱ���һ���֣���������Сд��ĸ�ֱ����һ�ֻ�ѧԪ�ء�
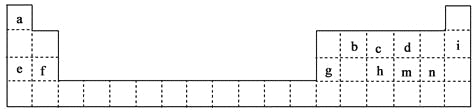
��1�������ϱ��ش��������⣺ ������Ԫ�����γ���������������_________����Ԫ�ط��ţ���m�������ӽṹʾ��ͼΪ_________��
��h��m��n���γɵ�����������ˮ�����������ǿ������˳��Ϊ_________���ѧʽ����
��d��e��f��g�γɵļ����ӵİ뾶��С�����˳��Ϊ_________�������ӷ�����д����
��2�������ܹ������Ƚ�m��n����Ԫ�طǽ�����ǿ������_________��
A���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
B����������Ԫ�صĵ��ʷֱ�������������Һ��Ӧ
C����n�ĵ���ͨ�뵽m���⻯���ˮ��Һ��
��3���ֱ�д�����з�Ӧ�����ӷ���ʽ:
g��d�γɵĻ����� ��e��d��a�γɻ������ˮ��Һ��Ӧ
c����̬�⻯����������������Ӧ��ˮ���ﷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ������Ҫ������
��1����֪��Ӧ2H2+O2 =2H2OΪ���ȷ�Ӧ����ͼ����ȷ��ʾ�÷�Ӧ�������仯���� ��

��ѧ�� | H��H | O��O | H��O |
����kJ/mol | 436 | 496 | 463 |
�Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯����ѧ���ļ�����������������1molˮ���Էų�����____________kJ
��2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ�У���Ƴ�ԭ��أ����������� , �����ķ�ӦʽΪ ���������Һ��SO42�� ���� �����������������һ��ʱ���ȡ��ϴ�����������������������Ϊ12.9 g��������ͨ���ĵ��ӵ����ʵ����� mol��
��3��һ���¶��£���3 molA�����1mol B����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ�����
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������ں˴Ź����������ܳ�������壬��������֮��Ϊ1:3����(����)
A. �� B. �������� C. �Զ��ױ� D. ��ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���˵����ȷ����( )
A. ����ʹ���Ը��������Һ��ɫ
B. �����Ӿ���ƽ���������νṹ��12��ԭ����ͬһƽ���ϣ���λ�ϵ�4��ԭ����һ��ֱ����
C. ����ʹ��ˮ��ɫ���Ƿ�����ȡ����Ӧ
D. ��������̼̼˫���ʲ��ܷ����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵıȽϣ�����ȷ����
A���ȶ���:H2O��NH3 B�����ԣ�NaOH��Al��OH��3
C�������ԣ�F2��Cl2 D�����ԣ� H2SO4��HClO4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com