
【题目】下列物质性质的比较,不正确的是
A.稳定性:H2O>NH3 B.碱性:NaOH>Al(OH)3
C.氧化性:F2>Cl2 D.酸性: H2SO4>HClO4
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(1)若在一定温度下,将1.0molNO、0.5molCO充入0.5L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8mol、0.3mol、0.2mol、0.1mol,该反应的化学平衡常数K= ;若保持温度不变,再向容器中充入CO、N2各0.3mol,平衡将 移动(填“向左”、“向右”或“不”)。
(2)CO可以合成甲醇。已知:
①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H=-1529kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1;
③2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1;
则CO(g)+2H2(g)![]() CH3OH(g) △H= kJ·mol-1。
CH3OH(g) △H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3 具有净水作用,但会腐蚀设备,请回答下列问题:
①FeCl3净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
②完成NaClO3 在酸性溶液中氧化FeCl2的离子方程式:
![]() ClO3—+
ClO3—+ ![]() Fe2++
Fe2++ ![]() ==
== ![]() Cl-+
Cl-+ ![]() Fe3++
Fe3++![]()
(2)工业上从海带中提碘,常用硫酸酸化的MnO2氧化I—,写出相关的离子方程式 。
(3)下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是强酸。当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
![]()
①当X是强酸时,写出B生成C的化学方程式 。
②当X是强酸时,写出浓的E溶液与过量的B反应的化学方程式 。
③当X是强碱时,简述检验B气体的操作方法和现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都能与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)A、C两元素形成的原子个数比为1:1的化合物,该化合物电子式为 。
(2)B元素的氢化物在催化剂存在的情况下与C元素单质反应的化学方程式为 。
(3)X的水溶液显 (填酸性、碱性或中性),原因是 (用离子方程式表示)。
(4)C和E两元素相比较,非金属性较强的是 (填“元素名称”),可以验证该结论的是 (填“序号”)。
A.比较这两种元索的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(5)C、D两元素形成的原子个数比为1:1的化合物,E、C两元素形成的原子个数比为1:2的化合物,这两种化合物反应的化学方程式为 。
(6)A与C、A与E可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲与乙反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图为实验室制备、收集少量HCl的装置。
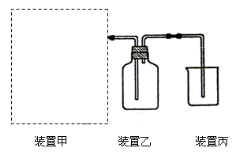
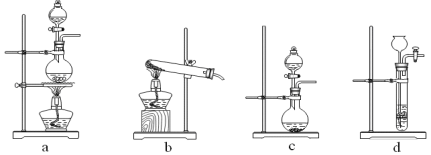
① 制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。

①按上图所示的装置图连接好各仪器。
②检验装置的气密性。
③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。装置C的作用是 。
④反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。其中试剂为 ,操作名称为 。
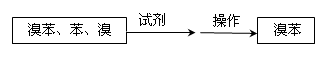
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA
B.50mL18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA
C.1 molFe溶于过量硝酸,电子转移数为2NA
D.78g Na2O2晶体中含有的离子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把任意比的NaHCO3和Na2O2的混合物放在密闭容器中加热.关于混合物加热前后消耗盐酸的物质的量,下列结论判断正确的是( )
A.加热前后一样多 B.加热前消耗的多
C.加热后消耗的多 D.当Na2O2适量时才会一样多无法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.实现化石燃料清洁利用,就无需开发新能源
C.为提高农作物的产量和质量,应大量使用化肥和农药
D.将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的有机化合物A(C6H6O)是重要的化工原料,在工业上能合成紫外线吸收剂BAD和治疗心脏病药物的中间体F,合成路线如下:

已知:BAD的结构简式为: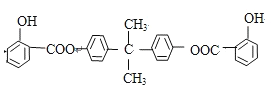
F的结构简式为: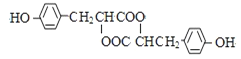
试回答:
(1)H中含有的官能团名称是 .
(2)写出X的结构简式 ,推测B的核磁共振氢谱中显示有 种不同化学环境的氢原子.
(3)写出反应类型 C→D ;E→F .
(4)1mol C与浓溴水反应,最多可以消耗 molBr2.
(5)C→D的过程中可能有另一种产物C1,请写出C1在加热条件下与足量稀NaOH水溶液
反应的化学方程式: .
(6)W的同分异构体有下列性质:与FeCl3反应,溶液呈紫色;能发生银镜反应;则该同
分异构体共有 种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com