
【题目】我国天然气化工的一项革命性技术是甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃等化工产品。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):

(1)A、C分子中所含官能团的名称分别为____、_______。
(2)写出A的同分异构体的结构简式:_______。
(3)写出下列反应的化学方程式和反应类型。
反应①:__________,反应类型:_____________;
反应②:___________;反应类型: _____________;
反应③:_____________,反应类型:_____________。
(4)下图为实验室制取D的装置图。

①图中试剂a名称为_______,其作用是______________。用化学方程式表示试剂a参与的化学反应:______________。
②实验结束后从混合物中分离出D的方法为_____________。
【答案】 羟基 羧基 CH3OCH3 CH2=CH2+H2O![]() CH3CH2OH 加成反立 2CH3CH2OH+O2
CH3CH2OH 加成反立 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH
2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 酯化反应或取代反应 饱和碳酸钠溶液 溶解乙醇,去除乙酸,降低乙酸乙酯的溶解度 Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑ 分液
CH3COOCH2CH3+H2O 酯化反应或取代反应 饱和碳酸钠溶液 溶解乙醇,去除乙酸,降低乙酸乙酯的溶解度 Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑ 分液
【解析】根据框图分析推A为CH3CH2OH、B为CH3CHO、C为CH3COOH、D为 CH3COOCH2CH3结合物质之间的转化关系进行解答。
(1)根据上述分析A为CH3CH2OH、C为CH3COOH分子中所含官能团的名称分别为羟基和羧基。答案:羟基和羧基
(2)A为CH3CH2OH其同分异构体为甲醚,结构简式: CH3OCH3。答案:CH3OCH3。
(3)反应①是乙烯和水的加成反应,化学反应方程式为: CH2=CH2+H2O![]() CH3CH2OH,反应类型为加成反应;反应②是乙醇的催化氧化反应生成乙醛, 化学反应方程式为2CH3CH2OH+O2
CH3CH2OH,反应类型为加成反应;反应②是乙醇的催化氧化反应生成乙醛, 化学反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应类型为氧化反应;反应③是乙醇和乙酸的酯化反应,化学反应方程式为CH3CH2OH+CH3COOH
2CH3CHO+2H2O;反应类型为氧化反应;反应③是乙醇和乙酸的酯化反应,化学反应方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,反应类型为酯化反应或取代反应。
CH3COOCH2CH3+H2O,反应类型为酯化反应或取代反应。
(4)此装置为制乙酸乙酯的反应。①图中试剂a名称为饱和碳酸钠溶液,其作用是溶解乙醇,去除乙酸,降低乙酸乙酯的溶解度。试剂a为饱和碳酸钠溶液能与乙酸反应,此化学反应的方程式为: Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑。
②D为 CH3COOCH2CH3,因为乙酸乙酯是难溶于水且密度比水小的液体,可用分液的方法从混合物中分离出。答案:分液。


科目:高中化学 来源: 题型:
【题目】一定条件下正戊烷(CH3CH2CH2CH2CH3)易发生两种裂解反应:
I.CH3CH2CH2CH2CH3(g)![]() CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
II.CH3CH2CH2CH2CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
(1)维持体系温度T不变,总压强p恒定时,体积为V1L的正戊烷发生裂解反应,一段时间平衡后气体体积变为V2L,此时正戊烷的转化率α(正戊烷)=_______;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将______(填“增大”“减小”或“不变”),原因为_____________。
(2)一定温度下,向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5molCH3CH3发生反应CH3CH=CH2(g)+CH3CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
①△H3=________。
②5min内,该反应的平均反应速率v(CH3CH3)=________。
③保持温度不变,起始时向该密闭容器中充入等物质的量的CH3CH=CH2和CH3CH3,平衡后容器内CH3CH3的体积分数为______(保留一位小数)。
(3)将0.1molCH3CH3完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
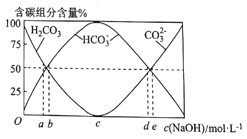
其中图中表示原氢氧化钠浓度为3mol.L-1的是_____(填“a”“b”“c”“d”或“e”)。
(4)以氢氧化钠溶液为电解质溶液,CH3CH3燃料电池的负极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料及催化剂等方面应用广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺流程:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___________________,“浸渣”的成分除Fe2O3,FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnC12将Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnC12后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,滴定时反应的离子方程式为____________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol,当除钙率达到99%时,除钙后的溶液中c(F-)=____mol·L-1[已知Ksp(CaF2)=4.0×10-11]。
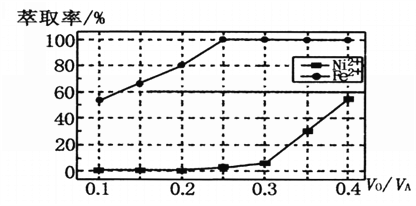
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: . X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 .
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号) .
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式) , 原因是 .
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式: .
(5)R的一种配合物的化学式为RCl36H2O.已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O
D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为: , 继续滴加氨水至过量,沉淀溶解, 得到天蓝色溶液,写反应的离子方程式为: .
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 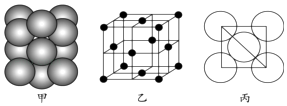
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为gcm﹣3(用字母表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排、开发新能源目前受到国际社会的高度关注。
(1)近年我国努力开发新能源,调整能源结构。下列属于可再生能源的是_______(填字母)。
A.氢能 B.天然气 C.石油 D.生物质能
(2)工业生产中会产生SO2、H2S等有害气体,可采取多种方法进行处理。
I.生物法脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(S04)3+2H2O
2Fe2(S04)3+2H2O
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______。
②由图1和图2判断使用硫杆菌的最佳条件为_____。若反应温度过高,反应速率下降,其原因是_____。

I.双碱法去除SO2的原理是先用NaOH溶液吸收SO2,再用CaO使NaOH再生。
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
写出过程①的离子方程式:______________。
(3)人们也利用多种方法回收利用烟气用的有害气体,变废为宝。如果利用NaOH溶液、石灰和O2处理硫酸工厂尾气中的SO2使之最终转化为石膏(CaSO4·2H2O),假设硫元素不损失,每天处理1000m3(标准状况)含0.2%(体积分数)SO2的尾气,理论上可以得到多少千克石膏 (计算结果保留小数点后一位)?_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.将Na2CO3固体加入新制的氯水中,有无色气泡(H+)
B.向淀粉KI溶液中滴加新制氯水,溶液变蓝(Cl2)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl﹣)
D.新制氯水使红色布条褪色(HCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质] ![]()
磷酸铁锂电池对环境无污染,为绿色环保型电池,是铅酸电池的替代品,该电池的总反应为:
Li1-x FePO4+LixC6= LiFePO4+C6
(1)基态Fe2+的核外电子排布式为___________,与Fe同周期的元素中,与铜原子最外层电子数相等的元素还有___________(填元素符号),磷酸铁锂电池总反应中涉及到的C、O元素,第一电离能较大的是____________________。
(2)PO43-的空间构型是____________________。
(3)与PCl5互为等电子体的一种分子的化学式为_________。
(4)二乙烯三胺五乙酸铁-钠络合物结构如图所示,其中C原子的杂化方式为_______________。

![]()
(5)亚铁氰化钾经氯气或电解氧化,可得铁氰化钾K3Fe(CN)6],为红棕色晶体,也称赤血盐,1mol该物质含有的π键的数目为_____________。
(6)已知:LiF晶体与 NaCl晶体结构相同,F半径为0.133nm,Li+的半径为0.076nm,阴阳离子相接触,则一个晶胞中离子的空间占有率为_______ (列式并计算),分析说明该计算结果小于74.05%的原因_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是( )
A.3:2
B.2:1
C.1:1
D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com