
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ. 配制50mL1.0mol/LFeBr2溶液;
ⅱ. 上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液常加少量HBr是为了_____________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_____________________。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上层清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
【答案】 抑制Fe2+的水解 Fe3+ 4Fe2++O2+4H+=4Fe3++2H2O Cl2+2Fe2+=2Cl-+ 2Fe3+ 溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝 静置后,上层溶液为黄色,下层溶液无色
【解析】(1)①FeBr2溶液中亚铁离子能够水解,加少量HBr可以抑制Fe2+的水解,故答案为:抑制Fe2+的水解;
②FeBr2溶液呈黄色,是因为含有铁离子,因亚铁离子具有还原性,易被空气中的氧气氧化,反应离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,故答案为:Fe3+;4Fe2++O2+4H+=4Fe3++2H2O;
(2)①Cl2具有强氧化性,可使Fe2+转化为Fe3+,自身被还原生成氯离子,离子方程式为:Cl2+2Fe2+=2C1-+2Fe3+,故答案为:Cl2+2Fe2+=2C1-+2Fe3+;
②铁离子具有氧化性、碘离子具有还原性,溶液中含有的Fe3+可与I-反应,二者发生氧化还原反应生成亚铁离子和碘单质,离子方程式为2Fe3++2I-=2Fe 2++I2,I2使淀粉变蓝,故答案为:溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝;
③少量Cl2与Fe2+反应,加入CCl4萃取后,静置后,上层溶液为黄色,为铁离子,下层溶液无色,说明不含有溴,因溴单质在四氯化碳中呈现紫色,故答案为:静置后,上层溶液为黄色,下层溶液无色。


科目:高中化学 来源: 题型:
【题目】pH=2的X,Y,Z三种酸的溶液各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法错误的是( ) 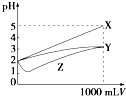
A.X是强酸,Y和Z是弱酸
B.稀释前的浓度大小为c(Z)>c(Y)>c(X)
C.稀释前电离程度大小为X>Y>Z
D.pH=2时,X,Y,Z都是稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把400 mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的溶液恰好反应完全。该混合溶液中c(Na+)为( )
A. (10b-5a) mol·L-1 B. (b-0.5a) mol·L-1
C. (![]() -
-![]() ) mol·L-1 D. (5b-
) mol·L-1 D. (5b-![]() ) mol·L-1
) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能通过化合反应直接制得的是
①Na2O2②NaHCO3③Al(OH)3 ④FeCl2⑤Fe(OH)3
A. 只有①②③ B. 只有①②④⑤
C. 只有①②④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
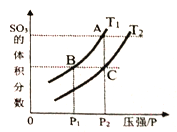
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前36号元素中的A、B、C、D、E、F的原子序数依次增大,只有前四种为短周期元素。A、B的原子核外s电子总数与p电子总数相等: C原子核外所有p轨道全满或半满: D元素的族序数与周期数的差为4;E是前四周期中电负性最小的元素:F在周期表的第七列。请根据以上相关信息,回答下列问题.
(1)A离子的电子共占据_____个轨道,A元素在自然界中的存在形态_____(a 只有化合态、b只有游离态、c都可能)。
(2)某人画的B的电子排布图如图![]() ,违背了________原理。
,违背了________原理。
(3)F位于______族,其基态原子的电子有_____种运动状态。
(4)CD3中心原子的杂化方式为____,用价层电子对互斥理论推测其分子空间构型为____,检验E元素的方法是___________。
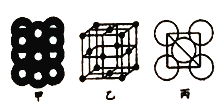
(5)若某金属单质晶体中原子的堆积方式如图甲所示,其品胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为______,该单质晶体中原子的堆积方式为四种基本堆积方式中的________,若已知该金属的原子半径为dcm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为________g/cm3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组的同学在完成课本乙醇氧化制乙醛的实验后,改进了实验方案(如图),进行如下实验操作(顺序已打乱):
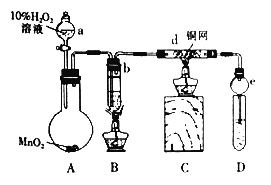
①点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热;
②向圆底烧瓶中滴加10%过氧化氢溶液;
③连接好仪器,检验装置的气密性;
④正确添加试剂;
⑤点燃C装置中的酒精灯
根据以上实验内容回答下列问题:
(1)实验操作顺序是 _____________________(填序号).
(2)装置e的作用是_____________________________________;
(3)写出d中发生反应的化学方程式____________________________________________;
(4)为检验D中收集的产物中是否含有乙醛,甲同学利用银氨溶液检验,请写出化学方程式_________________________________________________________;
(5)乙同学在一支试管中先加入2mL5%的CuSO4,滴加4﹣5滴NaOH溶液,再滴加几滴D中溶液,在酒精灯上加热,未出现砖红色沉淀,从而断定无乙醛生成.请你判断乙同学的说法是否合理,并说明理由___________________________________________________;
(6)若试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明液体中还含有____,要除去该物质,可先在混合液中加入_____(填写下列选项中的字母),然后再通过_____(填操作名称)即可除去.
A.饱和NaCl溶液 B.C2H5OH C.NaHCO3溶液 D.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解在化工生产、金属冶炼及科学研究等方面有重要应用。
(1)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石Na3AlF6) 在1000℃左右就可以得到熔融体。
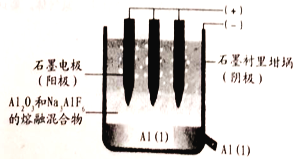
①写出电解时阳极的电极反应式:___________。
②电解过程中作阳极的石墨易消耗,原因是___________。
(2) 电解食盐水是氯破工业的基础。
①电解所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为____、_____。电解时,阴极反应的主要产物是___________。
②电解时用盐酸控制阳极区的pH在2~3,用必要的文字和反应方程式说明原因: ___________。
(3)Cu2O是半导体材料,工业上常用电解法制取。电解装置如下图所示。
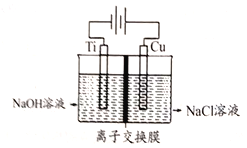
电解装置中采用离了交换膜控制阳极区OH-的浓度而制备纳米Cu2O。该离子交换膜是____(填“阴”或“阳”)离子交换膜,阳极生成Cu2O的电极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com