
【题目】对下列物质分类全部正确的是( )
①苏打 ②食盐水 ③石灰水 ④NaOH ⑤液氧 ⑥KClO3
A.纯净物—③④⑤B.混合物—②⑤
C.盐—①⑥D.碱—①④
科目:高中化学 来源: 题型:
【题目】1.76 g铜镁合金完全溶解于50 mL、密度为1. 40 g cm-3、质量分数为63%的浓硝酸中,得到NO2气体1 792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol L-1的NaOH 溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中的HNO3的物质的量浓度是14.0 mol L-1
B. 加入NaOH溶液的体积是50 mL
C. 浓硝酸在与合金的反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D. 得到的金属氢氧化物的沉淀为3.12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14molL-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用0.14molL-1NaOH标准溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下
滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ( )→( )→D→( ) →A→( ) →( ) __________
②配制准确浓度的稀H2SO4溶液,必须使用的主要容器是 ______
③观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 ______ (选填“偏高”“偏低”或“无影响”)
④计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)_____
⑤已知:含CH3COOH 1mol的醋酸溶液与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;含HCl1mol 的盐酸与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则CH3COOH在水溶液中电离的ΔH等于______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
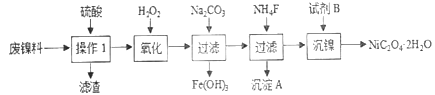
(1)操作1的名称为__________。
(2)保持其他条件相同,在不同温度下对废镍料进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为_______(填字母)。
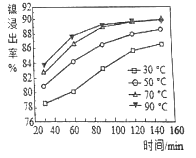
a.30℃、30min b.70℃、120min
c.90℃、150min d.90℃、120min
(3)沉淀A为CaF2和_________(填化学式)。
(4)试剂B的化学式为_________________。
(5)NiC2O4·2H2O样品经某稀酸酸化处理后,用稀KMnO4标准溶液滴定[在本实验条件下,Ni(Ⅱ)不能被氧化,其他物质不参与反应],通过测定草酸的量可测定NiC2O4·2H2O样品的纯度,滴定反应为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O。实验中称取0.183g样品,滴定时消耗了0.0400mol.L-1的KMnO4溶液8.00mL,则该样品中NiC2O4·2H2O的质量分数为_________。
(6)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体![]() 现象
现象![]() 现象
现象![]()
![]() 现象
现象![]() 现象
现象
①试剂1的名称为____________。
②证明混合气体有CO的现象是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
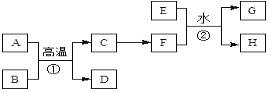
请回答下列问题:
(1)D的化学式是____。
(2)可选用____(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为____。
(4)反应②的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种化合物,如H2S、COS(羰基硫)、SO2等,它们对环境均有一定的影响。
(1)H2S经 K2CO3溶液吸收后,生成两种酸式盐。其中任意一种酸式盐的化学式是____。
(2)COS(羰基硫)燃烧时有SO2生成,其原理为:2COS+3O2![]() 2CO2+2SO2。若转移3.612×1024个电子,则参加反应COS(羰基硫)的物质的量是____mol。
2CO2+2SO2。若转移3.612×1024个电子,则参加反应COS(羰基硫)的物质的量是____mol。
(3)电厂排出的烟气中含有CO、SO2等。SO2能与H2S反应生成S和H2O,说明SO2具有____性。CO在催化剂存在时可与SO2反应,转化为一种固体和一种无害气体。该反应的化学方程式是___。
(4)石灰石作为脱硫剂,可有效吸收废气中的SO2,减少酸雨的产生。
①在煤炭中加入石灰石可减少燃烧时SO2的排放量,并生成CaSO4。该反应的化学方程式是____。
②你认为减少酸雨产生的途径可采取的措施是____(填序号)。
a.避免直接用高硫煤作燃料 b.把工厂的烟囱造高
c.燃料脱硫 d.开发新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有Ba(NO3)2、AgNO3、Fe(NO3)3的混合液。欲将Ba2+、Ag+、Fe3+分离,分别得到三种元素的不溶物,按下图所示实验:
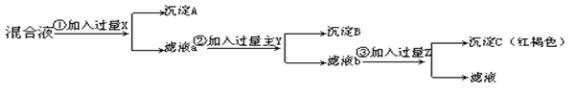
⑴加入的试剂分别是:X________,Y_________,Z_________。
⑵生成的沉淀A是__________,B是___________,C是___________。
⑶第②步和第③步的离子方程式分别是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是( )
A.用分液的方法分离水和酒精的混合物
B.进行分液时,分液漏斗中的上层液体上口倒出,下层液体下口流出
C.配制NaCl溶液时可用托盘天平称量5.85gNaCl固体
D.用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com