
����Ŀ������б��ʯ����Ҫ�ɷ�ΪKAlSi3O8����һ���¶ȷ�Χ�����Ȼ����۽����Ƶ��Ȼ��أ���Ӧԭ����NaCl(l)+KAlSi3O8(s)![]() KCl(l)+NaAlSi3O8(s)��
KCl(l)+NaAlSi3O8(s)��
��1����ԭ�������ĵ����Ų�ʽ___����ԭ�Ӻ�����ӵĹ��ʽ___����ԭ�Ӻ�����___�ֲ�ͬ�����ĵ��ӡ�
��2��������Ӧ�漰��Ԫ���У�ԭ�Ӱ뾶������___���÷�Ӧ��λ��ͬһ���ڵļ���Ԫ���У���һ��Ԫ�ص�����������ˮ���������Ԫ�ص�����������ˮ������ܷ�����Ӧ����Ԫ����___����ԭ�ӽṹ����ȥ������Ԫ�صĽ�����ǿ����Ԫ�ص�ԭ����___��
��3��Ϊ�о�������Ӧ�м�Ԫ�ص��۳��ʣ�Һ���м�Ԫ�ص�����ռ��Ʒ�����İٷ��ʣ����¶ȵĹ�ϵ�����ж���ʵ�飨���������������䣩������������ݣ�
ʱ��(h) �۳��� �¶� | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
860�� | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
950�� | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | �D |
�ٷ����������ݿ��Եó����Ȼ����۽��س�ʯ��___��������������������������Ӧ��
��950��ʱ��������۳��ص����ʿ��Բ�ȡ�Ĵ�ʩ��___��ѡ���ţ���
a����ֽ��� b���ӳ���Ӧʱ��
c������Ӧ��ϵ��ѹǿ d�����س�ʯ�۴�ɸ�С�Ŀ���
��2���÷����Ƶ�KCl�ᴿ�������ұ�������ء���ӦNa(l)+KCl(l)![]() NaCl(l)+K(g)�ǹ�ҵ��ұ�������س��õķ������÷����Ƿ���˵���Ʊȼظ����ã�___����������˵������������˵������ԭ����___��
NaCl(l)+K(g)�ǹ�ҵ��ұ�������س��õķ������÷����Ƿ���˵���Ʊȼظ����ã�___����������˵������������˵������ԭ����___��
���𰸡�1s22s22p63s23p5 ![]() 13 K Na ��Ԫ�غ���Ԫ�صĵ��Ӳ�����ͬ��������������С������ԭ�Ӱ뾶��ԭ�Ӵ�����ԭ�ӣ���ԭ�Ӷ��������ӵ�������С����ԭ�ӣ�������ԭ�Ӹ�����ʧȥ���ӣ�������ǿ���� ���� ad ����˵�� �÷����������۵�ߵĽ����Ʊ��۵�͵Ľ��������������Ƴ���Ӧ��ϵ��ʹƽ�������ƶ�
13 K Na ��Ԫ�غ���Ԫ�صĵ��Ӳ�����ͬ��������������С������ԭ�Ӱ뾶��ԭ�Ӵ�����ԭ�ӣ���ԭ�Ӷ��������ӵ�������С����ԭ�ӣ�������ԭ�Ӹ�����ʧȥ���ӣ�������ǿ���� ���� ad ����˵�� �÷����������۵�ߵĽ����Ʊ��۵�͵Ľ��������������Ƴ���Ӧ��ϵ��ʹƽ�������ƶ�
��������
��1����ԭ������������Ϊ7�����������Ų�ʽΪ��3S23P5,��ԭ�Ӻ��������Ϊ8����������Ų�ʽΪ��1s22s22p4��������ӹ��ʽΪ��![]() ����ԭ�Ӻ�����13�����ӣ���������������������ͬ��������13�ֲ�ͬ�����ĵ��ӣ��ʴ�Ϊ��3S23P5��
����ԭ�Ӻ�����13�����ӣ���������������������ͬ��������13�ֲ�ͬ�����ĵ��ӣ��ʴ�Ϊ��3S23P5��![]() ��13��
��13��
��2��������Ӧ�漰��6��Ԫ���У�K�ڵ������ڣ�ԭ�Ӱ뾶���Na��Al��Si��Cl����Ԫ�ص�����������ˮ����ΪNaOH��Al(OH)3��H2SiO3��HClO4��NaOH�ܺ�Al(OH)3��H2SiO3��HClO4��Ӧ����ԭ�ӽṹ������������Ԫ�غ���Ԫ�صĵ��Ӳ�����ͬ��������������С������ԭ�Ӱ뾶��ԭ�Ӵ�����ԭ�ӣ���ԭ�Ӷ��������ӵ�������С����ԭ�ӣ�������ԭ�Ӹ�����ʧȥ���ӣ�������ǿ������
�ʴ�Ϊ��K��Na����Ԫ�غ���Ԫ�صĵ��Ӳ�����ͬ��������������С������ԭ�Ӱ뾶��ԭ�Ӵ�����ԭ�ӣ���ԭ�Ӷ��������ӵ�������С����ԭ�ӣ�������ԭ�Ӹ�����ʧȥ���ӣ�������ǿ������
��3�����ɱ���֪����ͬʱ���ڣ��¶����ߣ���Ԫ�ص��۳�������˵���¶����ߣ������ڷ�Ӧ������У����ԣ��Ȼ����۽��س�ʯ�����ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��a������Ӧ��ĽӴ���������Լӿ췴Ӧ���ʣ�a��ȷ��
b���ӳ���Ӧʱ�䣬ƽ�����ʼ�С��b����
c������������μӵķ�Ӧ������ѹǿ����Ӧ�������÷�Ӧû��������룬��Ӱ�죻
c����
d�����س�ʯ�۴�ɸ�С�Ŀ�������������Ӧ��ĽӴ��������Ӧ��������d��ȷ��
�ʴ�ѡ��ad��
��2��K�û���Na������˵��Na��K���ã���Na(l)+KCl(l)![]() NaCl(l)+K(g)���Կ�����������K�ķе��Na�ͣ�ʹƽ�������ƶ����Ӷ��Ʊ�K��
NaCl(l)+K(g)���Կ�����������K�ķе��Na�ͣ�ʹƽ�������ƶ����Ӷ��Ʊ�K��
�ʴ�Ϊ������˵�����÷����������۵�ߵĽ����Ʊ��۵�͵Ľ��������������Ƴ���Ӧ��ϵ��ʹƽ�������ƶ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ��������ȡ��ϩʱ�������¶ȹ��߶���������Ӧ�������Ҵ���ŨH2SO4��Ӧ����SO2��CO2��ˮ������̿�ڡ�
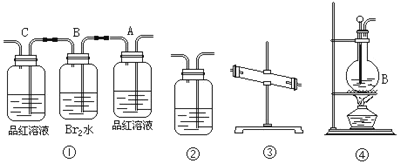
��1���ñ��Ϊ�����ܵ�ʵ��װ�����һ��ʵ�飬����֤������Ӧ��������к�CO2��SO2��ˮ��������װ�õ�����˳��(���������������ҵ�����)�� �� �� �� ��___
��2��ʵ���װ�ã�1����Aƿ��������___������Ϊ___��Bƿ�е�������___��Bƿ��Һ����Ϊ___����Cƿ��Ʒ����Һ����ɫ���ɵõ�����Ϊ___��
��3��װ�â��мӵĹ���ҩƷ��___������֤�����������___��װ�â���ʢ����Һ��___������֤�����������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨ�����ˮ��CN�� �ĺ�����ij��ѧС��������ͼ��ʾװ�ý���ʵ�顣�رջ���a����100ml�����ˮ�����NaClO��Һ����װ��B��Բ����ƿ�г�ַ�Ӧ������b������ϡ���ᣬȻ��رջ���b��
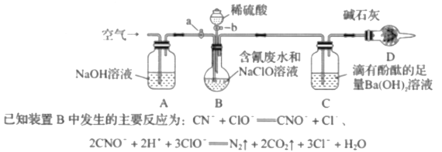
��1��B��ʢװϡ�����������������_____________��
��2��װ��D��������_________________��װ��C�е�ʵ������Ϊ______________��
��3����װ��B�з�Ӧ��������a������Aװ�û���ͨ��һ��ʱ��Ŀ���
�������װ��C������59.1mg���������ˮ��CN���ĺ���Ϊ_________mg��L-1 ��
������ȥװ��A��ֱ����װ��B�л���ͨ��һ��ʱ��Ŀ��������ú����ˮ��CN���ĺ���__________��ѡ����ƫ��������ƫС����������������
��4����B�е���ϡ�����ᷢ��ij������Ӧ������һ���ж��Ļ���ɫ���嵥�ʣ��ø���Ӧ�����ӷ���ʽΪ_________________��
��5����ȥ��ˮ��CN����һ�ַ������ڼ��������£���H2O2��CN����������N2����Ӧ�����ӷ���ʽΪ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4molN2O4����2L�����ܱ������з�����ӦN2O4(g) ![]() 2NO2(g)��ƽ����ϵ��N2O4������������������¶ȵı仯��ͼ��ʾ��
2NO2(g)��ƽ����ϵ��N2O4������������������¶ȵı仯��ͼ��ʾ��

��1��D��v(��)____v(��)�����������=������
��2��A��B��C������ƽ�ⳣ��K��ֵ������____�㡣T2ʱN2O4��ƽ��ת����Ϊ____����ƽ��ʱ��Ϊ5s�����ʱ���ڵ�N2O4ƽ����Ӧ����Ϊ____��
��3�������������䣬��T3ԭƽ������ϣ��ټ���һ����NO2���ﵽ��ƽ��ʱ����ԭƽ����ȣ�NO2���������____�����������С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص绯ѧװ�õ�˵����ȷ���ǣ� ��
A.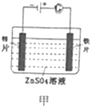 ��ͼװ�ÿ���ʵ����Ƭ�϶�п
��ͼװ�ÿ���ʵ����Ƭ�϶�п
B.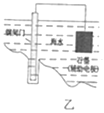 ��ͼ��ʾ��բ���������������������������Է���
��ͼ��ʾ��բ���������������������������Է���
C.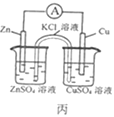 ��ͼ�У������е�K+��ʢ��ZnSO4��Һ���ձ����ƶ�
��ͼ�У������е�K+��ʢ��ZnSO4��Һ���ձ����ƶ�
D.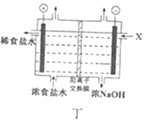 ��ͼ�У�X������ϡNaOH��Һ����ǿ��Һ������
��ͼ�У�X������ϡNaOH��Һ����ǿ��Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��������ݻ���Ϊ1.0L�ĺ����ܱ������з�����Ӧ:
CH3OH(g)+CO(g) ![]() CH3COOH(g)��H<0������˵����ȷ����
CH3COOH(g)��H<0������˵����ȷ����
������� | �¶�/K | ���ʵ���ʼŨ��/mol/L | ���ʵ�ƽ��Ũ��/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. ��ƽ��ʱ������I������II�е���ѹǿ֮��Ϊ3:4
B. ��ƽ��ʱ������II��![]() ������I�еĴ�
������I�еĴ�
C. ��ƽ��ʱ���������е�����Ӧ���ʱ�����I�еĴ�
D. ��ƽ��ʱ������I��CH3OHת����������III��CH3COOHת����֮��С��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�CO2���Ӿ����ת��Ϊ��������SiO2�ṹ��ԭ�Ӿ��壮�������Ϸ���������˵����ȷ���ǣ�������
A.��ת�������������仯
B.1molCO2ԭ�Ӿ����к�2mol C��O��
C.CO2ԭ�Ӿ�����۵����SiO2
D.CO2��ԭ�Ӿ���ͷ��Ӿ��廥Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����ͺ���Ԫ�صĻ��ϼ����о��������ʵ�������Ҫ�ӽǣ����仯�������̬�仯Ϊ����Ķ�άת����ϵ��ͼ1��ʾ��
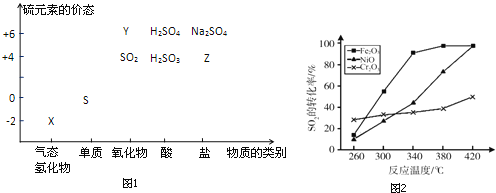
���������գ�
��1��ͼ��X�ĵ���ʽΪ__����ˮ��Һ�ڿ����з����ױ���ǣ�д����Ӧ�Ļ�ѧ����ʽ__���ñ仯˵��S�ķǽ����Ա�O__������ǿ����������������ԭ�ӽṹ�ĽǶȽ���ԭ��__��ͨ��__������������Ҳ�����ж�����������Ԫ�صķǽ�����ǿ����
��2��������������Na2S2O3�Ʊ�����������ԭ��Ӧ�ĽǶȣ��������п��ܵ���__��ѡ���ţ���
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
��3����֪��Ӧ��Na2S2O3+H2SO4��Na2SO4+S��+SO2+H2O���о��䷴Ӧ����ʱ�����з�����������__��ѡ���ţ���
a �ⶨһ��ʱ��������SO2��������ó��÷�Ӧ������
b �о�Ũ�ȡ��¶ȵ����ضԸ÷�Ӧ���ʵ�Ӱ�죬�ȽϷ�Ӧ���ֻ��ǵ�ʱ��
c ��Na2S2O3����ֱ���Ũ��ϡ���ᷴӦ���о�Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ��
��4��������CO��SO2���̵�������Fe2O3����������CO��SO2��380��ʱת��ΪS��һ�������壮��֪��������۵㣺112.8�桢�е㣺444.6�棻�ڷ�Ӧÿ�õ�1mol�ų�270kJ��������д���������̵�����Ӧ���Ȼ�ѧ����ʽ__��
��5������������ͬ��������ͬʱ��������Ӧ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼ2�������Ǵ����۸����أ�������ѡFe2O3����������Ҫԭ����__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ������ȼ�ϵ�ؾƾ�����ǣ������Զ����������������ƵĹ��ܣ��dz��ʺϽ����ֳ��ƾ���⣬����˵������ȷ����
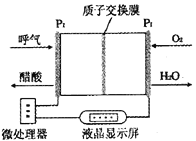
A.������O2���ڵIJ��缫�����·���������缫
B.�õ�صĸ�����ӦʽΪ��CH3CH2OH+3H2O-12e-=2CO2��+12H+
C.O2���ڵIJ��缫��������ԭ��Ӧ
D.������ͨ����������С����������������оƾ��ĺ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com