
����Ŀ��������ͭ�Ǻϳ��������������в���������������ͭ����Ҫǰ����֮һ���ɲ��ñ�����Ϊԭ����ʵ���ҽ��кϳɡ��Ʊ��������װ����ͼ�����Ⱥͼг�װ�õ��ԣ�����֪����������۵�Ϊ76.5����������ˮ�������Ҵ���
��250mL����ƿ���м���70mL��������Ϊ70�������ᣬ������100�����ٻ��� ����40�籽���棬Ȼ��������130����������Ӧ

��ش�
��1������b��������_______���������� __________________________����Ӧ�������������ˮ�ٷ�����������Ʒ��������ˮ��Ŀ����______��
��2��������ֱ��������õ��������ǣ�����ĸ��______��
a��©�� b����Һ©����c���ձ� d�������� e��ֱ��������
��3������������뵽�Ҵ���ˮ�Ļ���ܼ��У�����ܽ�����Cu��OH��2������30min�����ˣ���Һ����һ��ʱ���������������ͭ���壬д��������Ӧ�Ļ�ѧ����ʽ ___________������ܼ����Ҵ���������_______________��
��4���ᴿ�ֱ��������յõ�44�紿Ʒ��������IJ�����_________�������������Է�������117�����������Է�������136��
���𰸡� ���������� �������� ���ͱ�������ܽ�ȣ����ڱ��������� acd 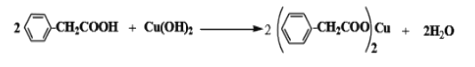 �ܽⱽ���ᣬ���ڳ�ַ�Ӧ 95%
�ܽⱽ���ᣬ���ڳ�ַ�Ӧ 95%
����������1���������������������bΪ���������ܣ�ʹ������Һ��������������Ϊ��Ӧ���������Ũ���ᣬ����Ҫ������ﵹ����ˮ�У���Ӧ�������������ˮ�������¶ȣ���С��������ܽ�ȣ��������ˮ�ɱ��ڱ������������ʴ�Ϊ���������������������������ͱ�������ܽ�ȣ����ڱ�������������2�����뱽�����Ʒ�����ù��˲���������Ҫ������Ϊ©�����ձ�������������ѡacd����3������������뵽�Ҵ���ˮ�Ļ���ܼ��У�����ܽ�����������ͭ��������ˣ���Һ����һ��ʱ���������������ͭ���壬��Ӧ����ʽΪ��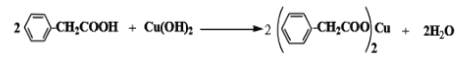 ��������������ˮ�������Ҵ���Ϊ�˳�ַ�Ӧ������ܼ��м��Ҵ�����������ܽ�ȣ����ڳ�ַ�Ӧ���ʴ�Ϊ��
��������������ˮ�������Ҵ���Ϊ�˳�ַ�Ӧ������ܼ��м��Ҵ�����������ܽ�ȣ����ڳ�ַ�Ӧ���ʴ�Ϊ�� ���ܽⱽ���ᣬ���ڳ�ַ�Ӧ����4���ɷ�Ӧ
���ܽⱽ���ᣬ���ڳ�ַ�Ӧ����4���ɷ�Ӧ![]() ��֪��40g ���������ɱ�����Ϊ
��֪��40g ���������ɱ�����Ϊ![]() �����յõ�44g��Ʒ��������IJ���Ϊ44/46.5��100%=95%���ʴ�Ϊ95%��
�����յõ�44g��Ʒ��������IJ���Ϊ44/46.5��100%=95%���ʴ�Ϊ95%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�־ֲ����������������Ĥ������ȵ���ʹ��һ���Ƴ������˨��ʹ�ã����Ĺ�ҵ�ϳ���������ʾ������;����;�����ѱ�����̭������ʹ�ý϶����;������

��֪���ٵ����������м�ʱ�������������������Ҫ����������λ���λ���������������Ȼ�ʱ�������������������Ҫ�������ļ�λ��
�ڱ�����![]() �������еİ����ױ�������
�������еİ����ױ�������
��ش��������⣺
��1��������B�Ľṹ��ʽΪ________��
��2����Ӧ�ߵĻ�ѧ����ʽΪ______________________________________________��
��3�����й��������ϳ�·�ߵ�˵����ȷ����________��
a����Ӧ�ٳ�����Ҫ����A�����⣬���������� �ȣ�
�ȣ�
b��;�����еIJ���ٺ͢ݿ��Ի�����
c����Ӧ�۵���һ������H2O��
d����;������ȣ�;������ȱ���Dz���࣬���ʵͣ�
e��;�����еIJ���۵�Ŀ���DZ�����������������е�KMnO4������Һ������
��4��;�����еIJ���ݺ͢��ܻ�����________��������_______________________��
��5�����������ж���ͬ���칹�壬������2����λȡ��������NH2ֱ�����ڱ����ϣ����ӽṹ�к���������ͬ���칹���У�
 ��________��________��
��________��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ba(OH)2��Һ����������Һ�У�ʹSO42-ȫ��ת����BaSO4��������ʱ��Ԫ�ص���Ҫ������ʽ�� �� ��
A.AlO2��B.Al(OH)3C.Al3+D.Al3+��Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������һ�����ܱ������м���1mol N2��3mol H2������Ӧ��N2+3H2 ![]() 2NH3������Ӧ�Ƿ��ȷ�Ӧ���������й�˵����ȷ���ǣ� ��
2NH3������Ӧ�Ƿ��ȷ�Ӧ���������й�˵����ȷ���ǣ� ��
A.�ﵽ��ѧ��Ӧ��ʱ��������2mol NH3
B.���������ټ���N2 �� ���Լӿ췴Ӧ����
C.�����¶ȿ��Լӿ췴Ӧ����
D.1mol N2 ��3mol H2������������2mol NH3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(D)�������ϵ�ԭ�ϣ�������A�ϳɵõ���

A. ��B��C�ķ�Ӧ����ȥ��Ӧ
B. D����������̼ԭ��һ������
C. �����ʵ�����B�ֱ���������Na��NaHCO3��Ӧ����������������ʵ���ǰ�ߴ��ں���
D. ��A����2-��-1��3-����ϩ�ͱ�ϩ��(CH2=CHCOOH)���ȵõ��ģ���÷�Ӧ���������ڼӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���淴ӦΪ��A��g��+B��g��2C��g��+2D��s����H��0����֪�÷�Ӧ��K=1��10��2��ش�
��1���÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��2��T�棬���ܱ�������A��B��C��Ũ�ȷֱ�Ϊ2.5��10��1molL��1��4.0��10��2molL��1��3.0��10��2molL��1 �� ��ʱ��Ӧ������ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С����������� ��
��3��T��ʱ����1L�ܱ������г���A��B��1mol��ƽ��ʱB��ת������%������һλС��������ʱ��ϵ�ڵ�ѹǿ�뷴Ӧǰ��ѹǿ��Ϊ ��
��4������º��ݵ��ܱ������г���1molA��1molB���ﵽƽ��״̬���������г���2molC��3molD�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ����������C�������������������С���������䡱�����жϡ�����
��5����A��B�Ļ�����������º����ܱ������У����б仯������ȷ����������ĸ��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��������ڹ��ܸ߷��Ӳ��ϵ���(����)
���л��������ںϳ����۸߷��ӷ���Ĥ��������߷��Ӳ��ϡ����������ϡ���Һ���߷��Ӳ��ϡ��߹����߷��Ӳ��ϡ������ܸ߷��Ӳ���
A.ֻ�Т٢ۢܢޢ�
B.ֻ�Тڢܢޢߢ�
C.ֻ�Тڢܢޢߢ�
D.ֻ�Тۢܢݢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N2��H2����2L�ܱ������У���Ӧ2min������0.8molNH3 �� �����ʱ���ڣ���N2Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ�� ��
A.0.05molL��1min��1
B.0.1molL��1min��1
C.0.2molL��1min��1
D.0.4molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ҩ���������м��壬��ṹ��ʽ��ͼ�������й�������ȷ������ ��

A. ���л�������ˮ�����ӳɷ�Ӧ
B. ���л�����Ũ�����ϼ��ȿɷ�����ȥ��Ӧ
C. 1 mol���л���������NaOH��Һ��Ӧ�������3 mol NaOH
D. ���л��ᆳ���������ܷ���������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com