
【题目】下列物质中,同时具有离子键和极性共价键的是( )
A.NH3
B.NH4Cl
C.H2S
D.KCl
科目:高中化学 来源: 题型:
【题目】(选修5——有机化学基础)
呋喃(C4H4O)是生产抗流感药物磷酸奥司他韦(又名达菲)的原料之一,以玉米芯为原料制备呋喃及相关衍生物的一种工艺流程如下:
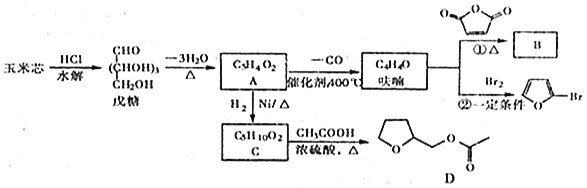
已知:ⅰ)A可以发生银镜反应
ⅱ)![]()
(1)D的分子式为___________________。
(2)呋喃的结构简式为___________;②的反应类型为________________。
(3)A发生银镜反应的化学方程式 ____________________________________________。
(4)C生成D的化学方程式__________________________________________。
(5)反应①在有机合成中具有重要意义,则B的结构简式为__________ 。
(6)C的同分异构体中,含有“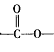 ”结构的共有____________ 种(不含立体导构),其中能发生很镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为________ 。
”结构的共有____________ 种(不含立体导构),其中能发生很镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修3:物质结构与性质]东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
氨的沸点______(填“高于”或“低于”)膦(PH3),原因是_________________
氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为______。
(3)单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol-1,ICu>INi的原因是_______________________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于处于化学平衡状态的反应CO+H2O(g)![]() CO2+H2中,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是( )
CO2+H2中,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是( )
A. K正反应=K逆反应 B. K正反应>K逆反应
C. K正反应<K逆反应 D. K正反应×K逆反应=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3S+6KOH=K2SO3+2K2S+3H2O中,被还原与被氧化的硫原子数之比为
A. 1:2 B. 2:1 C. 1:1 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量铜片与含0.2mol H2SO4的浓硫酸共热,反应生成的SO2的分子数为0.1NA
B. 室温下,0.3molL-1的Na2SO4溶液中含Na+ 数目为0.6NA
C. 标准状况下,NA个SO3分子所占的体积约为22.4L
D. NO2和N2O4的混合物共9.2g,其中所含氧原子数一定为 0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
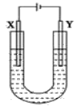
(1)X的电极名称是________极,发生的电极反应式为:_______________________。Y极的电极材料是__________,检验X极产物的方法是___________________________________________。
(2)写出该电极总反应的离子方程式:___________________________________。
(3)若食盐水为100mL 两极共放出2.24L气体(标准状况),则电路中通过电子的物质的量为___________。(假定电解后仍为100mL)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 写出镍原子的电子排布式_____________。
(2) 丙酮(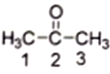 )分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
)分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成_______molAgCl沉淀。
(4)H2O分子的键角比H2S分子的键角大,原因是_______ 。
(5)N,P属于同族元素,但是它们的简单氢化物NH3,PH3在水中溶解度差异很大,其原因是 _________
(6) 由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
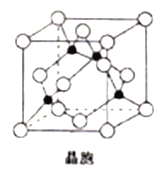
①该晶体的化学式为_______。
②将晶胞内的4个黑点相互连接所形成的立体构型是_______。
③晶体中与一个氯原子距离最近的氯原子有_______个。
④已知该晶体的密度为ρg.cm-3,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为_______pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原子利用率最高的是
A. 工业制漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B. 工业制备钠2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. 火法炼铜3Cu2S+3O2![]() 6Cu+3SO2
6Cu+3SO2
D. 现代石油工业采用银做催化剂生产环氧乙烷2CH2=CH2→![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com