
【题目】如图所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
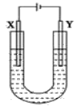
(1)X的电极名称是________极,发生的电极反应式为:_______________________。Y极的电极材料是__________,检验X极产物的方法是___________________________________________。
(2)写出该电极总反应的离子方程式:___________________________________。
(3)若食盐水为100mL 两极共放出2.24L气体(标准状况),则电路中通过电子的物质的量为___________。(假定电解后仍为100mL)
【答案】 阳 2Cl--2e-=Cl2↑ Fe 用湿润的淀粉-碘化钾试纸放在X极附近,若试纸变蓝,说明Cl2产生 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 0.1mol
2OH-+H2↑+Cl2↑ 0.1mol
【解析】(1)用石墨和铁作电极电解饱和食盐水,根据反应,则铁作阴极,溶液中的氢离子在铁电极上得电子生成氢气,石墨作阳极,溶液中的氯离子在石墨上失电子生成氯气,根据氯气能使湿润的淀粉碘化钾试纸变蓝来检验;
(2)电解饱和食盐水生成氢氧化钠、氢气和氧气;
(3)根据反应2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑计算转移电子数。
2OH-+H2↑+Cl2↑计算转移电子数。
(1)用石墨和铁作电极电解饱和食盐水,根据反应,则铁作阴极,应为Y,溶液中的氢离子在铁电极上得电子生成氢气,石墨作阳极,应为X,溶液中的氯离子在石墨上失电子生成氯气,电极反应为2Cl--2e-=Cl2↑;由于氯气能使湿润的淀粉碘化钾试纸变蓝来检验,所以检验X极的产物方法是用湿润的淀粉-碘化钾试纸放在X极附近,若试纸变蓝,说明有Cl2产生;
(2)电解饱和食盐水生成氢氧化钠、氢气和氧气,方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)电解饱和食盐水生成氢氧化钠、氢气和氧气,即2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,两极放出2.24L即0.1mol气体(标准状况),由方程式可知产生2mol气体转移2mol电子,则电路中通过电子的物质的量为0.1mol。
2OH-+H2↑+Cl2↑,两极放出2.24L即0.1mol气体(标准状况),由方程式可知产生2mol气体转移2mol电子,则电路中通过电子的物质的量为0.1mol。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:
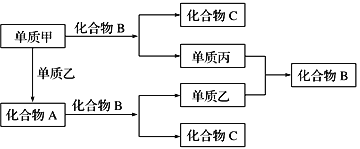
(1)向酚酞试液中加入化合物A的粉末,现象为________。
(2)单质甲与化合物B反应的离子方程式为__________。5.05g单质甲—钾合金溶于200mL水生成0.075mol氢气,确定该合金的化学式为______ 。
(3)向一定体积某浓度的化合物C的溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况。
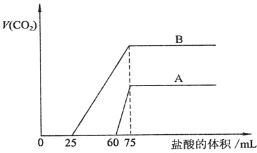
①由A确定滴加前60mL的盐酸时,发生反应的离子方程式为_____________________
②B对应的溶液M低温蒸干后得到固体a克,将a克固体充分加热至恒重后,固体质量减少 _____ 克。
③由A、B可知,两次实验通入的CO2的体积比为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①能量越低的物质就越稳定;②白磷转化成红磷是放热反应。据此判断下列说法中正确的是( )
A.在相同的条件下,红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构相同
D.红磷容易发生自燃而白磷则不会自燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为:![]()
(1)A的分子式为_____.
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物.当有1mol A发生反应时,最多消耗_____mol NaOH.
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为_____.
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体._____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,e是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。下列说法正确的是
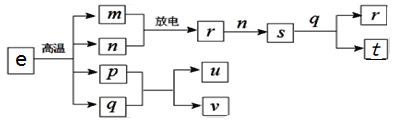
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z<Y
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 钠与水反应: Na +2H2O![]() Na++2OH– + H2↑
Na++2OH– + H2↑
B. 向氢氧化钡溶液中加入稀硫酸: Ba2++OH–+ H++ ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
D. 向碳酸氢铵溶液中加入足量石灰水: Ca2++![]() +OH–
+OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_______(填具体元素符号或化学式,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的子式是_________,第三周期中碱性最强的化合物的化学式是____________________。
(3)最高价氧化物是两性氧化物的元素是____________;写出它最高价氧化物对应水化物与氢氧化钠反应的化学方程式_______________________________________。
(4)用电子式表示元素④与⑥形成化合物的形成过程:________________________,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)表示③与①最高价态形成的化合物电子式___________________,该化合物分子由___________(填“极性”“非极性”)键形成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氧气氧化某浓度Fe2+为Fe3+过程的实验结果,下列有关说法正确的是
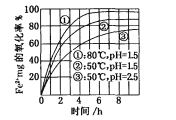
A. pH=1.5时氧化率一定比pH=2.5时大
B. 其他条件相同时,80℃的氧化率比50℃大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com