
| A、该气体的相对分子质量是44 |
| B、该气体的体积是22.4L |
| C、该气体的质量是44G |
| D、该气体的原子数是3NA |
科目:高中化学 来源: 题型:
| A、该分散系放置一段时间可能很快出现分层现象 |
| B、有丁达尔效应 |
| C、不能透过滤纸 |
| D、所得分散系一定是浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何物质都含有约6.02×1023个原子 |
| B、常温常压下,4.4 g CO2气 体含有6.02×1022个CO2分子 |
| C、常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D、标准状况下,33.6 L H2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L CO2中含有分子数为NA |
| B、常温常压下,28 g N2所含有的分子数为NA |
| C、1 L K2SO4溶液中N(K+)=4NA,则 c(K2SO4)=4 mol/L |
| D、物质的量浓度均为1 mol/L,体积均为1L的CH3COOH和HNO3溶液,电离出的H+数都为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2L氮气所含原子数为NA |
| B、常温常压下,1mol甲基(-CH3)所含电子数为10NA |
| C、500mL0.5mol?L-1的CaCl2溶液中,含有Cl-的数目为0.25NA |
| D、92gNO2和92gN2O4所含有原子数均为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
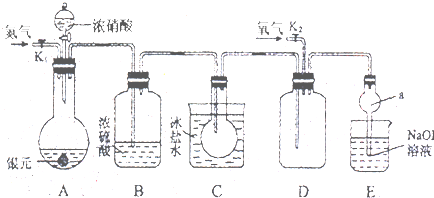
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com