
【题目】从某些植物树叶提取的挥发油中含有下列主要成分: 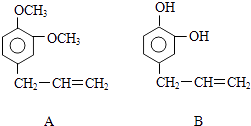
(1)写出A的分子式 .
(2)1molB与溴水充分反应,需消耗mol单质溴 .
(3)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式: .
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述不正确的是 ( )

A. 碳[C(s)]的燃烧热△H< -110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O吸收73kJ的热量
C. 2Cu2O(s)+O2(g)=4CuO(s) △H=-292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H= -35.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 同一生物体不同组织细胞内化学元素种类大体相同
B. C、H、O、N是组成生物体内抗体所必需的元素
C. 蛋白质中的S元素存在于氨基酸的R基中
D. 核酸中的N存在于碱基中,蛋白质中的N主要存在于羧基中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在容积固定的密闭容器中反应,达到平衡状态的标志是
2NO+O2在容积固定的密闭容器中反应,达到平衡状态的标志是
A. 单位时间内生成n mol O2的同时生成2n mol NO
B. 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
C. 混合气体的颜色不再改变的状态
D. 混合气体的总质量不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子交换膜燃料电池(简称:PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是
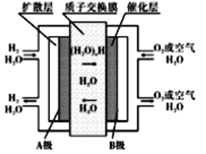
A. 可用一氧化碳代替图中氢气形成质子交换膜燃料电池
B. B极的电极反应式为O2+4H++4e-=2H2O
C. 用该电池作为精炼铜的电源时,A极与粗铜电极相连
D. 当外电路中转移0.1mole-时,通过质子交换膜的H+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项 ( )

①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④常温下氧化性:F2<Cl2<Br2<I2
A. 1项 B. 2项
C. 3项 D. 4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 0.4 mol Cu2S 与足量稀硝酸反应,生成 Cu(NO3)2、S、NO 和 H2O,则参加反应的硝酸 中未被还原的硝酸的物质的量为
A.2 molB.1 molC.1.6 molD.2.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com