
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图:
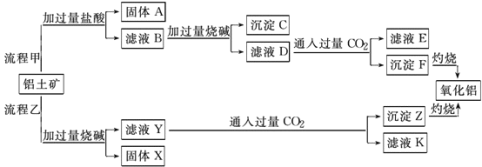
请回答下列问题:
(1)图中涉及分离溶液和沉淀所采取的操作名称是___,该实验操作用到的玻璃仪器___。
(2)检验滤液B含Fe3+,可取少量滤液并加入__(填试剂名称)。
(3)流程甲通入过量CO2后生成沉淀F的离子反应方程式为__。
(4)流程乙加入烧碱溶解SiO2的化学反应方程式___。
(5)能否将向溶液D中通入过量CO2换成加入过量盐酸?___(填 能 或 不能),其理由是___。
【答案】过滤 烧杯、玻璃棒、漏斗 KSCN AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2NaOH+SiO2=Na2SiO3+H2O 不能 过量盐酸与Al(OH)3反应产生AlCl3(或写为AlO2-+4H+=Al3++2H2O)
【解析】
由工艺流程甲可知,铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质),铝土矿与过量盐酸反应时,Al2O3、Fe2O3、MgO反应变为AlCl3、FeCl3、MgCl2以及过量的HCl,而SiO2不能反应,所以得到的固体A为SiO2,滤液B含有FeCl3、MgCl2、AlCl3、HCl,向滤液B中加入过量的NaOH,FeCl3、MgCl2反应产生Fe(OH)3、Mg(OH)2沉淀;AlCl3变为NaAlO2,HCl反应变为NaCl,因此可推知沉淀C为Fe(OH)3、Mg(OH)2沉淀,滤液D含有NaAlO2、NaCl、NaOH,向滤液D中通入过量CO2,NaAlO2反应生成Al(OH)3沉淀与NaHCO3,沉淀F为Al(OH)3,Al(OH)3分解产生Al2O3和H2O,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中加入过量的NaOH溶液,Al2O3、SiO2能和NaOH反应,生成NaAlO2、Na2SiO3,Fe2O3、MgO不能发生反应,所以固体X为Fe2O3、MgO等,滤液Y为NaAlO2、Na2SiO3、NaOH,向滤液Y中通入过量CO2,NaOH 反应产生NaHCO3,NaAlO2与过量CO2的反应产生Al(OH)3和NaHCO3,Na2SiO3反应产生H2SiO3沉淀,所以沉淀Z为Al(OH)3、H2SiO3,滤液K中含有NaHCO3。
据此分析解答。
根据上述分析可知:沉淀A是SiO2,溶液B中含有FeCl3、MgCl2、AlCl3、HCl,沉淀C为Fe(OH)3、Mg(OH)2,溶液D为NaAlO2、NaCl、NaOH,溶液E为NaCl、NaHCO3,沉淀F为Al(OH)3。固体X为Fe2O3、MgO,溶液Y为NaAlO2、Na2SiO3、NaOH,沉淀Z为Al(OH)3、H2SiO3,滤液K中含有NaHCO3。
(1)图中分离溶液和沉淀所采取的操作名称过滤,所用玻璃仪器有烧杯、玻璃棒、漏斗;
(2)验证滤液B中含Fe3+的方法是:取少量滤液向其中加入KSCN溶液,若溶液变血红色,证明滤液中含Fe3+;
(3)滤液D中含有NaAlO2、NaCl、NaOH,向滤液D中通入过量CO2,NaAlO2与CO2、H2O反应生成Al(OH)3沉淀与NaHCO3,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)流程乙中加入烧碱,NaOH与SiO2反应产生Na2SiO3和H2O,反应的化学反应方程式2NaOH+SiO2=Na2SiO3+H2O;
(5)溶液D中含有NaAlO2、NaCl、NaOH,向D中通入过量CO2气体,由于CO2与H2O反应产生的H2CO3是弱酸,不能与反应产生的Al(OH)3反应,最后会得到Al(OH)3沉淀;HCl是强酸,能够与两性氢氧化物Al(OH)3发生反应,所以若向溶液D中通入过量CO2换成加入过量盐酸,NaAlO2与少量HCl反应产生的Al(OH)3沉淀被过量盐酸溶解反应产生可溶性的AlCl3,所以不能用稀盐酸代替二氧化碳。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】光刻胶是大规模集成电路、印刷电路版和激光制版技术中的关键材料,某一光刻胶M的合成路线如下: (部分试剂、反应条件和产物已略去)
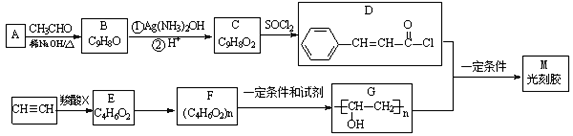
已知:
Ⅰ.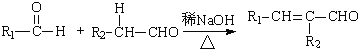 (R1,R2为烃基或氢)
(R1,R2为烃基或氢)
Ⅱ.![]() (R1,R2为烃基)
(R1,R2为烃基)
(1)写出A的结构简式______,B分子中的含氧官能团的名称为_______________。
(2)写出B与银氨溶液发生反应的化学方程式____________________________________。
(3)下列有关光刻胶M的说法正确的是______________________(填字母序号)。
a.可稳定存在于碱性溶液中
b.化学式为C11H10O2
c.可发生氧化反应、还原反应、取代反应
d. 1mol该物质与足量H2发生加成反应时可消耗4mol H2
(4)乙炔和羧酸X发生加成反应生成E,E的核磁共振氢谱有三组峰,且峰面积比为3:2:1, E能使溴水褪色且能发生水解反应,则F的结构简式为________________________。
(5)与C具有相同官能团且含有苯环的同分异构体还有______种(不考虑立体异构);C的另一种同分异构体满足下列条件:①能发生银镜反应和水解反应,其水解产物之一能与FeCl3溶液发生显色反应②苯环上的一氯取代产物只有两种,写出该同分异构体的结构简式:_________。
(6)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3CH2CH2COOH的合成路线流程图_______________________(无机试剂任意选用),合成路线流程图示例如下: CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍能形成多种不同的化合物。图1是镍的一种配合物的结构,图2是一种镍的氧化物的晶胞。判断下列说法不正确的是( )
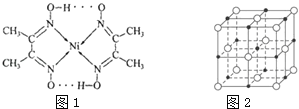
A.图2可能表示的是氧化镍(NiO)的晶胞
B.氧化镍中Ni2+、O2-的配位数都是6
C.镍原子位于元素周期表中第4周期ⅧB族,属于ds区元素
D.图1分子中存在的化学键有共价键、配位键、氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①符合通式CnH2n+2 的烃一定都是烷烃,分子中均只含单键
②苯能使溴水褪色,说明苯环结构中含有碳碳双键
③乙酸与油酸一定不是同系物
④乙烯能使溴水和酸性KMnO4 溶液褪色,且反应类型相同
⑤![]() 与
与![]() 是同分异构体
是同分异构体
⑥相同质量的烃完全燃烧,耗氧量最大的是 CH4
⑦戊二酸的分子式是C5H8O4,符合此分子式的二元酸有 3 种
A.①③⑦B.①③⑥C.②⑥⑦D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项正确的是
A. 钠与水反应的离子方程式:Na+H2O = Na++OH-+H2↑
B. 氯气与水反应的离子方程式:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O = Al(OH)3↓+3NH4+
D. 钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+ = 2Na++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是污染大气的主要物质之一。含二氧化硫的工业尾气可用如下方法来处理并制得有广泛用途的石膏。
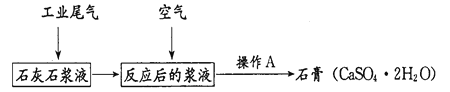
(1)SO2造成的一种常见环境污染为___;列举二氧化硫的一种用途___。
(2)SO2使紫色KMnO4溶液褪色的离子方程式为___;(提示:KMnO4 被还原为Mn2+)
(3)通空气时反应的化学方程式为___;若在实验室进行,操作A是_____。
(4)亚硫酸氢铵常用于造纸工业,若用某气体水溶液处理该工业尾气得到亚硫酸氢铵,则该气体为_______。
(5)有人提出在燃煤中加入适量的生石灰,可减少烟气中二氧化硫的排放,你认为是否合理?_______(填“合理”或“不合理”);理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
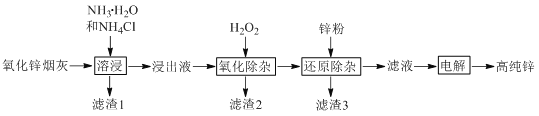
回答下列问题:
(1)Zn(NH3)42+中Zn的化合价为________,“溶浸”中ZnO发生反应的离子方程式为________。
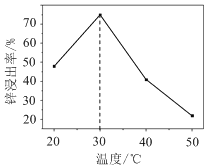
(2)锌浸出率与温度的关系如图所示,分析30 ℃时锌浸出率最高的原因为________。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为________。
(4)“滤渣3”的主要成分为________。
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是________(写化学式)。电解后的电解液经补充________(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 与
与![]() 、
、![]() 与
与![]() 分别位于同一主族,
分别位于同一主族,![]() 与
与![]() 可形成共价化合物
可形成共价化合物![]() ,
,![]() 原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A.![]() 分子中的所有原子最外层都为8电子结构
分子中的所有原子最外层都为8电子结构
B.![]() 、
、![]() 的化学键类型相同
的化学键类型相同
C.![]() 是共价化合物
是共价化合物
D.原子半径:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com