
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 与
与![]() 、
、![]() 与
与![]() 分别位于同一主族,
分别位于同一主族,![]() 与
与![]() 可形成共价化合物
可形成共价化合物![]() ,
,![]() 原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A.![]() 分子中的所有原子最外层都为8电子结构
分子中的所有原子最外层都为8电子结构
B.![]() 、
、![]() 的化学键类型相同
的化学键类型相同
C.![]() 是共价化合物
是共价化合物
D.原子半径:![]()
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图:
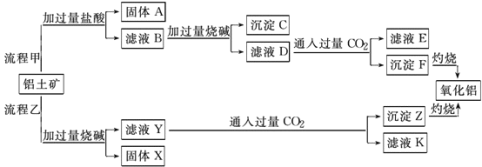
请回答下列问题:
(1)图中涉及分离溶液和沉淀所采取的操作名称是___,该实验操作用到的玻璃仪器___。
(2)检验滤液B含Fe3+,可取少量滤液并加入__(填试剂名称)。
(3)流程甲通入过量CO2后生成沉淀F的离子反应方程式为__。
(4)流程乙加入烧碱溶解SiO2的化学反应方程式___。
(5)能否将向溶液D中通入过量CO2换成加入过量盐酸?___(填 能 或 不能),其理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH = –511kJmol-1
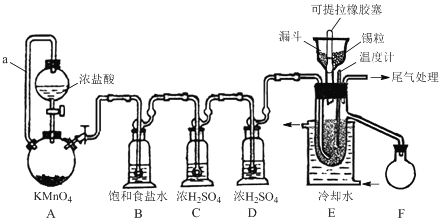
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a管的作用是________。
(2)A中反应的离子方程式是________。
(3)D的作用是________。
(4)E中冷却水的作用是________。
(5)尾气处理时,可选用的装置是________(填序号)。
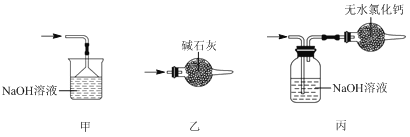
(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填序号)。
A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列体系中,离子能大量共存的是( )
A.含1.2 mol·L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br-
B.使酚酞变红的溶液:K+、Na+、![]() 、Cl-
、Cl-
C.滴加KSCN显红色的溶液:![]() 、K+、Cl-、I-
、K+、Cl-、I-
D.0.1 mol·L-1 NaHCO3溶液:Na+、Ba2+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素,前三种元素在周期表中的位置如图所示:
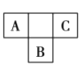
A、B、C三种元素中有两种元素的最高价氧化物对应的水化物是强酸,D元素的原子半径在短周期元素中最大,E是最高正价为![]() 的非金属元素。
的非金属元素。
(1)C在周期表中的位置是______
(2)A、B、C三种元素中两种元素所形成的两种强酸的分子式分别为______;上述五种元素形成的简单离子中,电子层结构相同的离子的半径由大到小的顺序为____________
(3)举例说明C的非金属性比B的非金属性强:____________
(4)D的单质与E所形成的最常见化合物能发生剧烈反应,写出相应的离子方程式:____________;A、E之间形成的最简单化合物(过量)与C的单质混合后可得到一种单质和一种盐,对应的化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a~g7种短周期主族元素,它们在元素周期表中的相对位置如图所示,请回答下列问题:
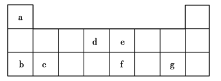
(1)下列选项中,元素的原子间最容易形成离子键的是______(填序号,下同),元素的原子间最容易形成共价键的是______。
A.![]() 和
和![]() B.
B.![]() 和
和![]() C.
C.![]() 和
和![]() D.
D.![]() 和
和![]()
(2)下列由a~g7种元素原子形成的各种分子中,所有原子最外层都满足8电子稳定结构的是______(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)由题述元素中的3种非金属元素形成的AB型离子化合物的电子式为______。
(4)![]() 与
与![]() 可形成一种化合物
可形成一种化合物![]() ,其含有的化学键类型为______,其与过量稀盐酸反应的化学方程式为______。
,其含有的化学键类型为______,其与过量稀盐酸反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)填写表中空格:
符号 | 质子数 | 电子数 |
___ | 1 | 0 |
| ___ | ___ |
| ___ | b |
(2)元素周期表中第五周期共有___种元素,若第五周期ⅤA族元素的原子序数为![]() ,则第五周期ⅡA族元素的原子序数为___(用含
,则第五周期ⅡA族元素的原子序数为___(用含![]() 的代数式表示,下同),第六周期ⅤA族元素的原子序数为____。
的代数式表示,下同),第六周期ⅤA族元素的原子序数为____。
(3)紧邻第Ⅷ族之后的一个纵行为第____族,元素周期表中所含元素种数最多的族是第___族。
(4)某元素的一种同位素![]() 的原子的质量数为
的原子的质量数为![]() ,含
,含![]() 个中子,它与
个中子,它与![]() 原子组成
原子组成![]() 分子,则
分子,则![]()
![]()
![]() 中所含质子的物质的量是___
中所含质子的物质的量是___![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体的性质与晶体类型和结构紧密相关。
(1)氯酸钾熔化时克服的作用力是______;二氧化硅熔化时克服的作用力是______;碘升华时克服的作用力是______。三种晶体的熔点由高到低的顺序是______(填化学式)。
(2)下列六种晶体:①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,⑤
,⑤![]() ,⑥金刚石,它们的熔点从低到高的顺序为______(填序号)。
,⑥金刚石,它们的熔点从低到高的顺序为______(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com