
【题目】A、B、C、D、E五种短周期主族元素,前三种元素在周期表中的位置如图所示:
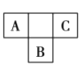
A、B、C三种元素中有两种元素的最高价氧化物对应的水化物是强酸,D元素的原子半径在短周期元素中最大,E是最高正价为![]() 的非金属元素。
的非金属元素。
(1)C在周期表中的位置是______
(2)A、B、C三种元素中两种元素所形成的两种强酸的分子式分别为______;上述五种元素形成的简单离子中,电子层结构相同的离子的半径由大到小的顺序为____________
(3)举例说明C的非金属性比B的非金属性强:____________
(4)D的单质与E所形成的最常见化合物能发生剧烈反应,写出相应的离子方程式:____________;A、E之间形成的最简单化合物(过量)与C的单质混合后可得到一种单质和一种盐,对应的化学方程式为____________
【答案】第二周期ⅦA族 ![]() 、
、![]()
![]() HF比H2S稳定(其他合理答案也可)
HF比H2S稳定(其他合理答案也可) ![]()
![]()
【解析】
对照A、B、C在周期表中的位置图,结合“A、B、C三种元素中有两种元素的最高价氧化物对应的水化物是强酸”,可推出A为氮、B为硫、C为氟。由“D元素的原子半径在短周期元素中最大”,可确定D为钠;由“E是最高正价为![]() 的非金属元素”,可确定E为氢。
的非金属元素”,可确定E为氢。
(1)由上面分析可知,C为氟,在周期表中的位置是第二周期ⅦA族。答案为:第二周期ⅦA族;
(2)A、B、C三种元素中,N、S两种元素所形成的两种强酸的分子式分别为HNO3、H2SO4;上述五种元素形成的简单离子中,电子层结构相同的离子为N3-、F-、Na+,依据“核电荷数越大,离子半径越小”的规律,半径由大到小的顺序为![]() 。答案为:HNO3、H2SO4;
。答案为:HNO3、H2SO4;![]() ;
;
(3)比较F和S的非金属性,可比较其氢化物的稳定性,从而得出证明C的非金属性比B的非金属性强的例子:HF比H2S稳定。答案为:HF比H2S稳定(其他合理答案也可);
(4)Na可与H2O发生剧烈反应,相应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;A、E之间形成的最简单化合物NH3(过量)与C的单质F2混合后,可得到一种单质N2和一种盐NH4F,对应的化学方程式为8NH3+3F2=N2+6NH4F。答案为:2Na+2H2O=2Na++2OH-+H2↑;8NH3+3F2=N2+6NH4F。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①符合通式CnH2n+2 的烃一定都是烷烃,分子中均只含单键
②苯能使溴水褪色,说明苯环结构中含有碳碳双键
③乙酸与油酸一定不是同系物
④乙烯能使溴水和酸性KMnO4 溶液褪色,且反应类型相同
⑤![]() 与
与![]() 是同分异构体
是同分异构体
⑥相同质量的烃完全燃烧,耗氧量最大的是 CH4
⑦戊二酸的分子式是C5H8O4,符合此分子式的二元酸有 3 种
A.①③⑦B.①③⑥C.②⑥⑦D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSe 、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态Se原子的电子占据最高能级的电子云轮廓图为________形。
(2)向FeSe中嵌入吡啶(![]() )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________。
②液氨是氨气液化的产物,氨气易液化的原因是________。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________。
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,对于指定项目的数目前后相等的是 ( )
A.电子数:17gOH—与1mol-OH
B.双键数目:1mol![]() 与4mol C2H4
与4mol C2H4
C.分子数:常温常压下16g氧气与4g氦气
D.阴离子总数:72gCaO2与62g Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子的最外层电子数是内层电子数的3倍,Y与X能形成两种化合物,Z所在的周期序数与族序数相同。下列说法正确的是( )
A.Y的单质能从Z的盐溶液中置换出Z
B.简单氢化物的热稳定性:![]()
C.Z与X两元素不能形成阴离子
D.简单离子的半径大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 与
与![]() 、
、![]() 与
与![]() 分别位于同一主族,
分别位于同一主族,![]() 与
与![]() 可形成共价化合物
可形成共价化合物![]() ,
,![]() 原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A.![]() 分子中的所有原子最外层都为8电子结构
分子中的所有原子最外层都为8电子结构
B.![]() 、
、![]() 的化学键类型相同
的化学键类型相同
C.![]() 是共价化合物
是共价化合物
D.原子半径:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、R、Q是短周期主族元素,部分元素的原子半径和化合价信息如下表所示:
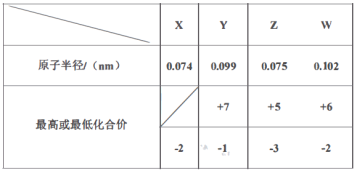
M的焰色反应为黄色:X、Y、R位于周期表中不同周期;Q的单质为半导体材料。
(1)Q元素在周期表中的位置是___;构成化合物M2X2的化学键类型是___。
(2)写出X、Y、R按原子个数之比为1:1:1形成的化合物的电子式___。
(3)Y与W相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
a.常温下W的单质呈固态,Y的单质呈气态
b.Y与W形成的化合物中W呈正价
c.Y和M反应时,lmolY原子所得电子数少于lmolW原子所得电子数
(4)R、W两种元素组成的离子在水溶液中与H+和OH-都不能大量共存,还能与氯水反应,写出其与新制氯水反应的离子方程式___。
(5)Z2R4为二元弱碱,在水中的电离与氨相似,写出其在水中的第一步电离方程式___,Z2R4与磷酸形成的磷酸二氢盐的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种。
①海水中镁的总储量约为1.8×1015t,海水里镁的存在形式是__(填“游离态”或“化合态”)。
②氯碱工业是重要的化学工业之一,写出该反应原理的离子方程式:__。
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①铁和铝是两种常见的金属材料,在空气中铝比铁耐腐蚀的原因是__。
②新型陶瓷氮化铝可用氧化铝高温还原法制备,化学方程式如下,请配平该化学反应方程式并标出电子转移方向和数目。_________
Al2O3+C+N2![]() AlN+CO
AlN+CO
(3)保持洁净安全的生存环境已成为全人类的共识。二氧化硫是引起酸雨的一种主要物质,必须严格控制排放。
①写出二氧化硫与足量NaOH溶液反应的离子方程式:__。
②酸雨降落到地面后,其中的亚硫酸在空气中被氧气逐渐氧化生成硫酸,使酸性进一步增强。写出这一过程的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
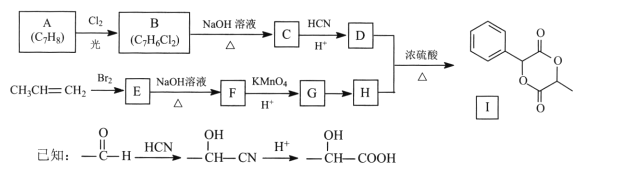
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com