
【题目】美国科学家John B.Goodenough荣获2019年诺贝尔化学奖,他指出固态体系锂电池是锂电池未来的发展方向。Kumar等人首次研究了固态可充电、安全性能优异的锂空气电池,其结构如图所示。已知单位质量的电极材料放出电能的大小称为电池的比能量。下列说法正确的是
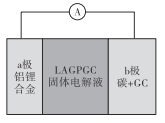
A.放电时,a极反应为:Al-3e-=A13+,b极发生还原反应
B.充电时,Li+由a极通过固体电解液向b极移动
C.与铅蓄电池相比,该电池的比能量小
D.电路中转移4mole-,大约需要标准状况下112L空气
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是
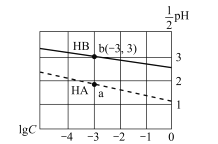
A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
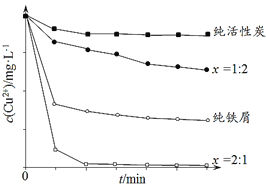
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g)。平衡体系中各组分的体积分数如下表:
2CO(g) + 2H2(g)。平衡体系中各组分的体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=________________。
②已知:CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H=-890.3kJmol-1,CO(g) + H2O(g) = CO2(g) + H2(g) △H=+2.8kJmol-1,2CO(g) + O2(g) = 2CO2(g) △H=-566.0kJmol-1,反应CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g)的△H=_______。
2CO(g) + 2H2(g)的△H=_______。
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成为乙酸。
①在不同温度下,催化剂的催化效率与乙酸的生成速率的变化关系如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。
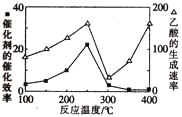
②为了提高该反应中CH4的转化率,可以采取的措施是__________________。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________。
(3)以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成的。写出聚碳酸酯的结构简式:__________。
②以氢氧化钾水溶液作为电解质进行电解,CO2在铜电极上可转化为甲烷,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素B3可以维持身体皮肤的正常功能,而且具有美容养颜的功效,其分子中六元环的结构与苯环相似。下列有关维生素B分子的说法错误的是
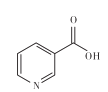
A.所有的碳原子均处于同一平面B.与硝基苯互为同分异构体
C.六元环上的一氯代物有4种D.1mol该分子能和4mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌银精矿化学成分如下:
元素 | Cu | Zn | Ag | S | Fe | Pb |
元素质量分数/% | 17.60 | 18.30 | 0.146 | 33.15 | 18.17 | 7.86 |
利用铜锌银精矿制备硫酸铜晶体的流程如下:

回答下列问题:
(l)“气体A”为____(填化学式),“浸渣”中主要为硫酸铅和____(填化学式)。
(2)“沉铜”得到Cu2Cl2固体,目的是____________。
(3)“氧化”工序中,恰好反应时氧化剂和还原剂物质的量之比为____。
(4)“母液2”中阴离子含量最多的是____,该溶液最好返回 __工序循环使用。
(5)依据铜锌银精矿化学成分进行分析,精矿中含有FeS2,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.向100mL0.5mol·L-1Fe(NO3)3溶液中通入足量SO2气体,转移电子数为0.05NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
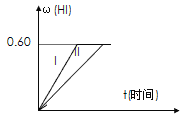
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com