
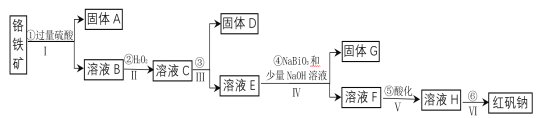
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42—,自身被还原为Bi(OH)3固体。
ii.
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
开始沉淀的PH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的PH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是___________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式________________。
(4)⑤中酸化是使CrO42—转化为Cr2O72—。写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
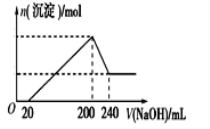
(6)取一定质量的固体D溶解于200mL的稀硫酸中,向所得溶液中加入5.0mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
【答案】增大反应物的接触面积,加快反应速率,提高浸出率 漏斗、烧杯 3NaBiO3+Cr2(SO4)3+7NaOH+H2O=2Na2CrO4+3Na2SO4+3Bi(OH)3 2CrO42—+2H+ ![]() Cr2O72—+H2O 冷却结晶 2.5mol·L-1 0.10mol
Cr2O72—+H2O 冷却结晶 2.5mol·L-1 0.10mol
【解析】
(1)根据影响反应速率的因素进行分析;
(2)操作I、III、IV均是过滤,根据过滤操作所需的仪器进行分析;
(3)NaBiO3有强氧化性,在碱性条件下,能将Cr3+转化为CrO![]() ,据此写出反应的化学方程式;
,据此写出反应的化学方程式;
(4)酸化是使CrO![]() 转化为Cr2O
转化为Cr2O![]() ,在转化过程中元素化合价不变;据此写出离子方程式;
,在转化过程中元素化合价不变;据此写出离子方程式;
(5)根据从溶液中得到晶体的一般操作进行分析;
(6)根据图像可知加入氢氧化钠时没有立即产生沉淀,这说明酸过量,首先发生酸碱中和;继续加入氢氧化钠溶液,沉淀逐渐增大,达到最大值,后氢氧化钠过量,沉淀部分溶解,说明沉淀为氢氧化铁和氢氧化铝;根据图像结合方程式和元素守恒进行分析计算。
(1)将铬铁矿石粉碎可以增大反应物的接触面积,加快反应速率,提高浸出率;
故答案为:增大反应物的接触面积,加快反应速率,提高浸出率;
(2)操作I、III、IV均是过滤,则用到的主要玻璃仪器有玻璃棒和漏斗、烧杯;
故答案为:漏斗、烧杯;
(3)常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO![]() ,则反应④的化学方程式为3NaBiO3 +Cr2(SO4)3+7OH-+H2O=Na2CrO4+3Na2SO4+3Bi(OH)3↓;
,则反应④的化学方程式为3NaBiO3 +Cr2(SO4)3+7OH-+H2O=Na2CrO4+3Na2SO4+3Bi(OH)3↓;
故答案为:3NaBiO3+Cr2(SO4)3+7NaOH+H2O=2Na2CrO4+3Na2SO4+3Bi(OH)3↓;
(4)⑤中酸化是使CrO42-转化为Cr2O72-,在转化过程中元素化合价不变,则该反应的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(5)从溶液中得到晶体的一般操作是蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠;
故答案为:冷却结晶;
(6)根据图像可知加入氢氧化钠时没有立即产生沉淀,这说明酸过量,首先发生酸碱中和;当沉淀不再发生变化时需要氢氧化钠是180mL;继续加入氢氧化钠沉淀开始减小,即氢氧化铝开始溶解,溶解氢氧化铝消耗的氢氧化钠溶液是40mL,则生成氢氧化铝消耗的氢氧化钠溶液体积是120mL,所以与铁离子反应的氢氧化钠溶液体积是60ml,物质的量是0.06mol/L×5mol/L=0.3mol,所以根据方程式Fe3++3OH=Fe(OH)3↓,所以铁离子是0.1mol,根据铁元素守恒可知,固体D中氢氧化铁的物质的量为0.1mol;沉淀达到最大值时溶液中的溶质是硫酸钠,则根据原子守恒可知硫酸钠的物质的量是![]() =0.5mol,则硫酸的浓度是
=0.5mol,则硫酸的浓度是![]() =2.5mol/L;
=2.5mol/L;
故答案是:2.5mol·L-1;0.10mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D都是含有碳、氢、氧三种元素的有机物,其中A、C分别是白酒和食醋中含有的成分,A、B、C、D间有如下转化关系:
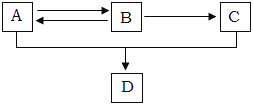
(1)A结构简式为___,C结构简式为___。
(2)写出A与C在浓H2SO4存在条件下加热反应生成D的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )
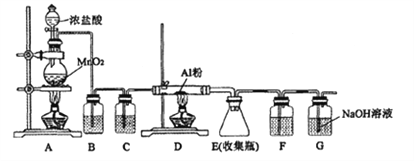
A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
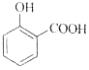 +2HCO3-→
+2HCO3-→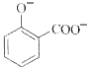 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )
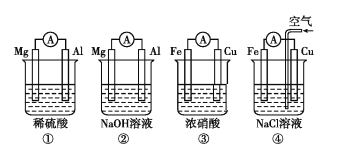
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-3e-=Fe3+
D.④中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
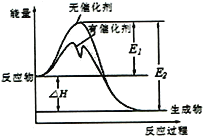
A. 该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能大于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-2akJ·mol-1
2SO3(g) ΔH =-2akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com