
【题目】下列离子方程式书写正确的是( )
A.碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
B.石灰石溶于盐酸中:CaCO3+2H+=Ca2++CO2↑+H2O
C.硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH﹣=Cu(OH)2↓
D.氧化铁与稀硫酸反应:Fe2O3+6H+=Fe2++3H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )
A.氨水B.盐酸C.醋酸D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有漂白作用的物质有(1)氯气 (2)二氧化硫 (3)活性炭 (4)过氧化钠,其漂白原理相同的是
A. (1)(3)B. (2)(3)C. (1)(4)D. (2)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有①CH3COOH②HCl③H2SO4三种溶液。根据要求回答下列问题:
(1)当它们pH相同时,其物质的量浓度最大的是________________(填序号)。
(2)当它们的物质的量浓度相同时,其pH最小的是____________(填序号)。
(3)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_________。(填序号)
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为_____________;此时所得到的三种溶液的pH大小关系为_______________(填序号)。
(5)若酸性FeCl2溶液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 自然界中硫是一种淡黄色难溶于水的固体
B. 硫的化合物常存在于火山喷出的气体中和矿泉水里
C. 硫与金属反应,生成金属的低价态化合物
D. 硫在空气中的燃烧产物是二氧化硫,纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)把盛满NO2和O2的混合气体的试管倒立于水中.
①若一段时间内水上升且充满试管,则原混合气体中NO2和O2的体积比是 , 若假设生成的溶质不向外扩散,且为标准状况.则所得溶液的物质的量浓度应为 . (保留二位有效数字)
②若一段时间后上升的水只升到试管容积的一半,则剩余的气体为(用化学式表示).原混合气体中,NO2和O2的体积比是 .
(2)二氧化氮和氨气在一定条件下,充分反应,得到非常稳定的产物,其化学方程式为:6NO2+8NH3=7N2+12H2O,若20mlNO2和NH3的混合气体在一定条件下发生上述反应,已知实际参加反应的NO2比NH3少2mL,则原混合气体中NO2和NH3的物质的量之比可能为
A.3:4
B.3:2
C.1:2
D.3:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 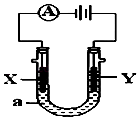
(1)若X,Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为 . 在X极附近观察到的现象是:
检验Y电极产物的方法是:
②电解总反应离子方程式为 .
(2)若X和Y仍均为惰性电极,a为CuSO 4 溶液,则电解时的化学反应方程式为
. 通过一段时间后,向所得溶液中加入16g CuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是
②Y电极的电极反应式是(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重克.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2 (g)═2SO3(g),其正反应放热.现有三个体积相同的密闭容器 I、Ⅱ、Ⅲ,按如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅲ中平衡常数相同
B.容器Ⅱ、Ⅲ中正反应速率相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:Ⅱ>Ⅲ
D.容器Ⅰ中SO2的转化率与容器 II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJmol﹣1
BaS(s)=Ba(s)+S(s)△H=+460kJmol﹣1
已知:2C(s)+O2(g)=2CO(g)△H=﹣221kJmol﹣1则Ba(s)+S(s)+2O2(g)=BaSO4(s)△H= .
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3﹣=2H3AsO4+3S+10NO2↑+2H2O,当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 .
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS﹣、S2﹣)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).①含硫物种B表示 . 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为(填字母).
a.c(Na+)=c(H2S)+c(HS﹣)+2c(S2﹣)
b.2c(Na+)=c(H2S)+c(HS﹣)+c(S2﹣)
c.c(Na+)=3[c(H2S)+c(HS﹣)+c(S2﹣)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是(用离子方程式表示).
(4)硫的有机物( ![]() )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O. ![]() 及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为 ![]() 的核磁共振氢谱图.写出X的结构简式: .
的核磁共振氢谱图.写出X的结构简式: . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com