
����Ŀ���ۺ�����ֲ��ո��ܱ��Ϊ������ͼ����ֲ��ո�Ϊԭ�Ϻϳ�������ͺ;�ּ���{���ӻ�����PET(�۶Ա��������Ҷ�����)��·�ߣ�

��ش��������⣺
(1)B�й����ŵ�����Ϊ___________��C����D�ķ�Ӧ������___________��
(2)д���ṹ��ʽ:A___________��C___________��
(3)��֪����ΪC17H33COOH������ع��͵���Ҫ�ɷ��������������д�������������������B����ȡ����Ӧ����������͵Ļ�ѧ����ʽ______________________��
(4)��ȡ�����㻯����W��E��ͬ���칹�壬��֪��
��W���ܷ���ˮ�ⷴӦҲ�ܷ���������Ӧ��
��0.5molW������̼��������Һ��Ӧ�����ɱ�״����0.5mol������̼������������W�Ľṹ��_____�֣�д������һ��������������Һ��Ӧ�Ļ�ѧ����ʽ______________________��
���𰸡��ǻ� �ӳɷ�Ӧ CH2OH(CHOH)4CHO CH3OOCCH=CH��CH=CHCOOCH3 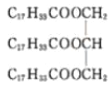 +3CH3CH2OH��
+3CH3CH2OH��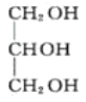 +3C17H33COOCH2CH3 18
+3C17H33COOCH2CH3 18 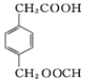 +2Ag(NH3)2OH��
+2Ag(NH3)2OH��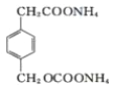 +2Ag��+2NH3+H2O
+2Ag��+2NH3+H2O
��������
�ոѵ���Ҫ�ɷ�Ϊ��ά�أ�ˮ��õ������ǣ�AΪ�����ǣ��ھƻ�ø��������Ϊ�����Ҵ������õ�������͡�������IJ�����״�����������Ӧ������D�Ľṹ��ʽ������D�гɻ�����ΪDiels_Alder��Ӧ�������������Ӧ�õ�PET���ϡ�
(1)�������ھƻ�ø�������µõ��Ҵ���B�Ĺ�����Ϊ��OH��Ϊ�ǻ���C��D�ķ�Ӧ���ͣ����ݷ���ʽ��C�ķ���ʽC8H10O4����ϩ�ķ���ʽΪC2H4��D�ķ���ʽC10H14O4���ӷ���ʽΪ�ӳɷ�Ӧ����Ϊ�ǻ� �ӳɷ�Ӧ��
(2)AΪ�����ǣ�Ϊ���ǻ�ȩ���ṹ��ʽΪCH2OH(CHOH)4CHO��CΪHOOC��CH=CH��CH=CH��COOH��״����ɵ�������ΪCH2OH(CHOH)4CHO CH3OOCCH=CH��CH=CHCOOCH3��
(3)�������Ϊ��֬�����������߸�֬�����������������������Ҵ���Ӧ�����ɸ��ͺ�֬������������Ϊ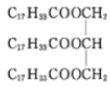 +3CH3CH2OH��
+3CH3CH2OH��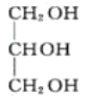 +3C17H33COOCH2CH3��
+3C17H33COOCH2CH3��
��4��E���˱���������2��ȡ������������������ȡ��������ͬ���칹������ڡ��䡢�ԡ���3�֡��ܷ���ˮ�����ܷ���������Ӧ��������ȩ������������0.5molW������̼��������Һ��Ӧ�����ɱ�״����0.5mol������̼������һ���Ȼ�����ֻ��4��Oԭ�ӣ���2�����ڡ�COOH����һ�������ż�Ҫˮ����Ҫ����������Ӧ��ֻ���Ǽ���������OOCH������ȡ������6��̼ԭ�ӣ�һ����6��������ֱ�Ϊ-CH2CH2COOH�ͣ�OOCH����CH(CH3)COOH�ͣ�OOCH����CH2COOH����CH2OOCH����COOH����CH2CH2OOCH����COOH����CH(CH3)OOCH����CH3����CH(COOH)OOCH��ÿ�����3�֣�һ��18�֣���ѡһ��д����ʽ��ע���Ȼ�Ҳ��Ͱ���Ӧ����Ϊ18 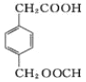 +2Ag(NH3)2OH��
+2Ag(NH3)2OH��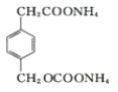 +2Ag��+2NH3+H2O��
+2Ag��+2NH3+H2O��


 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�25��ʱ����0.10 mol/L�İ�ˮ�ζ�10.00 mL 0.05 mol/L�Ķ�Ԫ��H2A����Һ���ζ������м��백ˮ�����(V)����Һ�� �Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. H2A�ĵ��뷽��ʽΪH2A![]() H++HA -
H++HA -
B. B����Һ�У�ˮ�������������Ũ��Ϊ1.0��10-6 mol/L
C. C����Һ�У�c(NH4+)+c(NH3��H2O)= 2c(A2-)
D. 25��ʱ���ð�ˮ�ĵ���ƽ�ⳣ��Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijƷ��ʳ�õ��ΰ�װ�ϵIJ������֣�������������ȷ����

A. ��װ�ϵģ���I�ƣ��еġ�I��ָ���ǵ�Ԫ��
B. ���������ˮ�ĵ��뷽��ʽΪ��KIO3===K++I��+O2��
C. ����ȱ��������״���״�
D. ��ʳƷ���������Ч��ֹ����طֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������ʵ����˵��NH3H2OΪ������ʵ���
A. 0.1 molL-1 NH3H2O��Һ��pHС��13
B. Al(OH)3��Ũ��ˮ�в����ܽ�
C. ��ͬ�����£�Ũ�Ⱦ�Ϊ0.1 molL-1��NaOH��Һ�Ͱ�ˮ����ˮ�ĵ���������
D. ��0.1 molL-1 NH3H2O��Һ�м���MgCl2��Һ������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú�����ѳ�SO2��NOx�Խ��������Ⱦ����Ҫ�����������ķ����ܶ࣬һ��ClO2������������Ӧ���������ʳ�����K������:
����:��NO(g)+ ClO2(g)= NO2(g)+ ClO(g) ��H1 k1=l.7��1011mL��(mol��s)-1
��NO(g)+ ClO(g)= NO2(g)+Cl(g) ��H2 k2=8.8��1012 mL��(mol��s)-1
����SO2(g)+ClO2(g)=SO3(g)+ClO(g) ��H3 k3=2.1��10-4 mL��(mol��s)-1
��SO2(g)+ClO(g)=SO3(g)+ Cl(g) ��H 4 k4=6.9��1011 mL��(mol��s)-1
�������в�����Cl����ClO2��һ����Ӧ����:
��C1(g)+ClO2(g)=2ClO(g) ��H5
��1��ͬʱ����������ӦNO(g)+SO2(g)+2ClO2(g)=NO2(g)+SO3(g)+ 2ClO(g)�ķ�Ӧ��������ʽ��H=____________��
��2����֪��Ӧ�ۢܵ����ʷ��̷քeΪv��=k3��c (SO2) �� c (ClO2)��v��=k4��c (SO2) �� c (ClO)�����ж�����Ӧ�Ļ�ܴ�С��E3____________E4���>����<����=���������������ٶȵĹؼ�������____________��Ӧ����ۻ�ܣ�
��3��SO2��NO����������ͬʱ�����������������ʱ仯��ͼ��ͬʱ������____________�����������Ӱ�����ԣ���Ϣ٢ܷۢ�Ӧ�������ʳ�������ԭ��____________��

��4��������ˮ����������ߣ�SO2���������ʻ�Ѹ�����������������ֳ������ᣬ��д���ù��̻�ѧ��Ӧ����ʽ__________________________________��
��5����ʪʽ���շ����������ռ���SO2������Ӧ�Ӷ�������Ŀ�ġ�
�������ʺ����÷����ռ�����____________������ţ���
A����ˮ B�� Na2SO4��Һ C�� Na2CO3 ��ҺD�� NaHSO4��Һ
����ʯ��ˮҲ������SO2���������������Һ��
���� CaSO3(s)+H+(aq)![]() Ca2+(aq)+HSO3-(aq)��ƽ�ⳣ��K=____________��25��ʱ��H2SO3���볣��Ϊ��K1=1.41��10-2��K2=6.30��10-8 Ksp=6.76��10-3
Ca2+(aq)+HSO3-(aq)��ƽ�ⳣ��K=____________��25��ʱ��H2SO3���볣��Ϊ��K1=1.41��10-2��K2=6.30��10-8 Ksp=6.76��10-3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����֤�����ᣨHCOOH��һԪ�ᣩΪ������ǣ� ��
A��0.1mol/L�����pHΪ2.3
B����pH=2�ļ���ϡ��100������Һ��pHС��4
C���¶����ߣ���Һ�ĵ���������ǿ
D���������Ũ�ȵļ����HCl��������п��Ӧ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯�����ڿ�ѧ�о���ҵ�����о�����Ҫ����;��
��1�����Ȼ�����Һ���ڼ���ʳ���㾫������������ʱ����������ɫ�����������ӽṹ��ͼ��ʾ��
�ٴ�������У������Ӽ۵����Ų�ͼΪ_____��
�ڴ���������̼ԭ�ӵ��ӻ��������Ϊ_____��
�۴��������к��еĻ�ѧ��Ϊ_____��
A�����Ӽ� B�������� C�����Լ� D���Ǽ��Լ� E����λ�� F����� G������ H������
��2��NO2-�������γɵ�������[Co(NO2)6]3-�����ڼ���K+�Ĵ��ڡ�NO2-���ӵ�VSEPRģ������Ϊ_____��K3[Co(NO2)6]�ǻ�ɫ������������������Ԫ�صĵ縺���ɴ�С��˳����_____��
��3���о����ʴ��Ա��������������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�á�������������V2O5��CrO2�������ʺ���¼�����ŷ�ԭ�ϵ���_____��

��4���̵�һ�������Ļ�ѧʽΪMn(BH4)2(THF)3��д��������BH4-��Ϊ�ȵ��������_____����дһ�����Ӻ�һ�����ӣ���
��5��ZnS��ӫ���塢�����ϡ�Ϳ�ϡ����ϵ���ҵ��Ӧ�ù㷺������ZnS����Ľṹ��ͼ��ʾ��a����λ��Ϊ_____����֪�����ܶ�Ϊ�� g/cm3��������2��b��֮��ľ���Ϊ_____nm���м���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ʱ���������CO��NOx�ȶ�����Ⱦ���壬�漰�����·�Ӧ:
��N2(g)+O2(g)![]() 2NO(g)
2NO(g)
��2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
��NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
Ū��������Ӧ����ػ������Ա����������������شش���������:
(1)������±�������գ�N2(g)+O2(g) ![]() 2NO(g) ��H=________��
2NO(g) ��H=________��
���� | N2 | O2 | NO |
����(kJ) | 946 | 497 | 811.25 |
(�Ͽ�1mol�����л�ѧ������Ҫ������)
(2)ʵ���÷�Ӧ2NO(g)+O2(g)![]() 2NO2(g) ��H<0�ļ�ʱ��Ӧ�����������¹�ϵʽ��
2NO2(g) ��H<0�ļ�ʱ��Ӧ�����������¹�ϵʽ��
v��=k����c2(NO)��c(O2)��v��=k����c2(NO2)��k����k��Ϊ���ʳ��������¶�Ӱ��
���¶�ΪT1ʱ����1L�ĺ����ܱ������У�Ͷ��0.6 molNO��0.3 molO2�ﵽƽ��ʱO2Ϊ0.2 mol���¶�ΪT2ʱ���÷�Ӧ����k��=k������T1_______ T2 (��������������С��������������)��
���о����ָ÷�Ӧ�����²�����У�
��һ����NO+NO![]() N2O2 ����ƽ�� �ڶ�����N2O2 +O2
N2O2 ����ƽ�� �ڶ�����N2O2 +O2![]() 2NO2 ����Ӧ
2NO2 ����Ӧ
���пɽ�����Ϊ�ڶ�����Ӧ��Ӱ���һ����ƽ�⣬��һ����Ӧ�У�v1��=k1����c2(NO)��v1��=k1����c(N2O2)
����������ȷ����______
A.ͬһ�¶��£�ƽ��ʱ��һ����Ӧ��![]() Խ��Ӧ����̶�Խ��
Խ��Ӧ����̶�Խ��
B.�ڶ�����Ӧ���ʵͣ����ת����Ҳ��
C.�ڶ����Ļ�ܱȵ�һ���Ļ�ܵ�
D.������Ӧ�������ɵڶ�����Ӧ���ʾ���
(3)��ѧ���о�����һ�ָ�Ч���������Խ�CO��NO2����ת��Ϊ����Ⱦ���壬��Ӧ����ʽΪ��2NO2(g)+4CO(g) =4CO2(g)+N2(g) ��H<0
ij�¶��£���10L�ܱ������зֱ����0.1molNO2��0.2 molCO������������Ӧ�����ŷ�Ӧ�Ľ��У������ڵ�ѹǿ�仯���±���ʾ��
ʱ��/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
ѹǿ/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
�ش��������⣺
���ڴ��¶��£���Ӧ��ƽ�ⳣ��Kp=_________kPa-1(KpΪ�Է�ѹ��ʾ��ƽ�ⳣ������������ȷ��С�����2λ)���������¶Ȳ��䣬�ٽ�CO��CO2����Ũ�ȷֱ�����һ������ƽ��_____(���������������������������ƶ���)��
�������¶Ƚ��ͣ��ٴ�ƽ�����ԭƽ�������ϵѹǿ(p��)��α仯��_______(����������������С������������)��ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Bodensteins�о���ӦH2(g)��I2(g)![]() 2HI(g)���¶�ΪTʱ�������������Ϊ1 L���ܱ������н���ʵ�飬������������е⻯������ʵ�������w (HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
2HI(g)���¶�ΪTʱ�������������Ϊ1 L���ܱ������н���ʵ�飬������������е⻯������ʵ�������w (HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
������� | ��ʼ���� | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2��0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
�о�����������Ӧ�У�v����ka��w(H2)��w(I2)��v����kb��w2(HI)������ka��kbΪ����������˵����ȷ���ǣ�
A. �¶�ΪTʱ���÷�Ӧ![]()
B. ����I����ǰ20 min��ƽ������v(HI)=0.0125 mol��L��1��min��1
C. ����ʼʱ������I�м������ʵ�����Ϊ0.1 mol��H2��I2��HI����Ӧ�������
D. ���������д���ka��= ka����kb��= kb������x��ֵ����Ϊ�κ�ֵ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com