
【题目】硫酸是一种重要的工业原料,广泛应用于炼油、冶金、染料等工业中。硫酸性质是中学化学学习的重点。
请回答下列问题:
(1)写出中学化学中利用物质与浓硫酸共热产生不同类别的两种气体的名称:___、___。
(2)浓硫酸脱水性实验教材中如下操作:取20g蔗糖置200mL烧杯中,加2mL水,搅拌均匀。再加入20mL98%的浓硫酸,迅速搅拌,静置。实验中,生产大量含SO2、CO2等混合气体。写出产生该混合气体的化学方程式:___。
(3)有学生改进了浓硫酸的脱水性实验(装置如图):
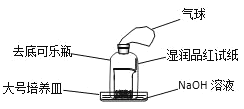
实验准备就绪后,加入浓硫酸,迅速搅拌后用去底可乐瓶罩上,观察现象。除看到烧杯中白色蔗糖颜色变深,体积膨胀,有气体产生外,还可看到哪些现象?___。
(4)图中,仪器a、b的名称分别是___、___;其中,仪器b常用于操作___(填一种物质提纯操作)。

(5)有学生为了确定浓硫酸使蔗糖脱水过程中产生SO2、CO2气体,请选用上述装置(可重复使用)设计实验,将它们的编号填入方框,并将装置内所放的化学药品填入括号内___。
![]()
(浓硫酸,蔗糖)________________________。
【答案】氯化氢 乙烯 C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O 品红试纸褪色、可乐瓶中液面稍上升、气球先鼓胀,后又逐渐瘪掉 长颈漏斗 分液漏斗 分液或萃取分液 BCCC 品红试液 溴水或酸性高锰酸钾 品红试液或溴水或酸性高锰酸钾 澄清石灰水
2SO2↑+CO2↑+2H2O 品红试纸褪色、可乐瓶中液面稍上升、气球先鼓胀,后又逐渐瘪掉 长颈漏斗 分液漏斗 分液或萃取分液 BCCC 品红试液 溴水或酸性高锰酸钾 品红试液或溴水或酸性高锰酸钾 澄清石灰水
【解析】
(1)实验室用氯化钠和浓硫酸反应制取氯化氢,用乙醇在浓硫酸的作用下加热反应制取乙烯气体;
(2)浓硫酸具有氧化性,能氧化碳单质;
(3)根据碳单质、浓硫酸以及SO2的性质来回答;
(4)根据实验仪器的名称和用途来回答判断;
(5) SO2的检验用品红,CO2的检验用澄清石灰水,检验CO2之前先是将SO2除净。
(1)实验室用氯化钠和浓硫酸反应制取氯化氢,用乙醇在浓硫酸的作用下加热反应制取乙烯气体;
(2)浓硫酸具有氧化性,能氧化碳,反应方程式为:C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(3)浓硫酸具有氧化性,能氧化碳,生成CO2、SO2,气球先鼓胀,其中的SO2具有漂白性,使得品红试纸会褪色,SO2、CO2均会合NaOH发生反应,使得气压降低,所以可乐瓶中液面稍上升,气球会逐渐瘪掉;
(4)仪器a、b的名称分别是长颈漏斗、分液漏斗,分液漏斗用于互不相溶液体的分液或萃取分液;
(5)浓硫酸使蔗糖脱水过程中产生SO2、CO2气体,B是发生装置。SO2的检验用品红,CO2的检验用澄清石灰水,检验CO2之前先是将SO2除净,所以C中装品红,褪色证明产生了SO2,在经过盛有溴水或高锰酸钾的试剂瓶,将SO2吸收,再经过品红看是否将SO2除尽,如果溴水或高锰酸钾不褪色,最后用澄清石灰水检验CO2的生成。故答案为:B、C、C、C;品红试液、溴水或酸性高锰酸钾、品红试液或溴水或酸性高锰酸钾、澄清石灰水。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
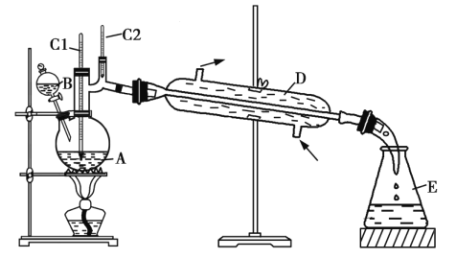
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。所发生的转化过程为![]() 。
。
反应物和产物的相关物理性质如表所示。
性质 | 沸点 | 密度 | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将![]()
![]() 放入
放入![]() 烧杯中,加
烧杯中,加![]() 水溶解,再缓慢加入
水溶解,再缓慢加入![]() 浓硫酸,将所得溶液小心转移至
浓硫酸,将所得溶液小心转移至![]() 中。在
中。在![]() 中加入
中加入![]() 正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加
正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加![]() 中溶液。滴加过程中保持反应温度为
中溶液。滴加过程中保持反应温度为![]() ,在
,在![]() 中收集
中收集![]() 以上的馏分。将馏出物倒入分液漏斗中,分去水层,将有机层干燥后蒸馏,收集
以上的馏分。将馏出物倒入分液漏斗中,分去水层,将有机层干燥后蒸馏,收集![]() 馏分,产量为
馏分,产量为![]() 。
。
回答下列问题:
(1)实验中,能否将![]() 溶液加入浓硫酸中,说明理由:________________。
溶液加入浓硫酸中,说明理由:________________。
(2)加入沸石的作用是______________,若加热后发现未加入沸石,应采取的正确措施是_____________。
(3)上述装置图中,![]() 仪器的名称是______,D仪器的名称是______。
仪器的名称是______,D仪器的名称是______。
(4)将正丁醛粗产品置于分液漏斗中分离水时,水在______(填“上”或“下”)层。
(5)反应温度应保持在![]() ,其原因是______________________________。
,其原因是______________________________。
(6)本实验中,正丁醛的产率为______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________,若所得硝酸密度为ρg/cm3,则其物质的量浓度为_______(保留两位小数)。
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为________m3(保留两位小数)。
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数_____________。
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
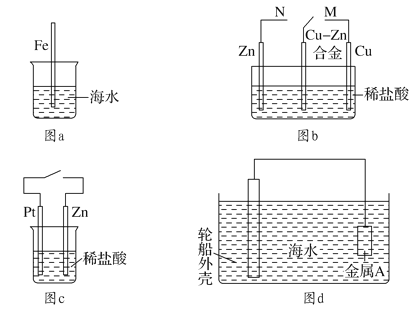
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子核外电子排布式为___。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___ (填序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
II中转化的基本反应类型是___,该反应过程能析出KClO3晶体而无其它晶体析出的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
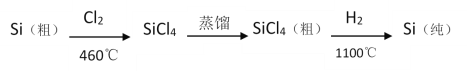
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得生成7kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___。
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和甲酸甲酯互为同分异构体,其结构式分别如下
 和
和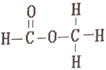
在下列哪种检测仪上显示出的信号是完全相同的
A. 李比希元素分析仪 B. 红外光谱仪
C. 核磁共振仪 D. 质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是

A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
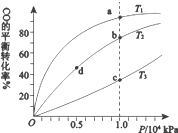
A.温度:T1>T2>T3
B.正反应速率:v(b)>v(d) v(a)>v(c)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示原电池的盐桥中装有饱和K2SO4溶液,电池工作一段时间后,甲烧杯中溶液颜色不断变浅。下列叙述中正确的是

A. b极是电池的正极
B. 甲烧杯中K+经盐桥流向乙烧杯
C. 甲烧杯中溶液的pH逐渐减小
D. 电池的总反应离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com