
【题目】下列有关实验原理或操作正确的是
A. 用干燥洁净的玻璃棒蘸取![]() 溶液,点到置于表面皿的pH试纸上测pH
溶液,点到置于表面皿的pH试纸上测pH
B. 氢氧化钠固体或碱石灰既可与浓氨水作用制得氨气,也可用于干燥氨气
C. 双氧水不稳定,见光、遇热、遇大多数金属氧化物都会加快它的分解,但在碱性环境下分解较慢
D. 海带中提取碘的过程中,可用过量的氯气或双氧水氧化水溶液中的![]() ,得到碘单质
,得到碘单质
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是
A. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,溶液中离子浓度的大小顺序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. pH=4的0.1molL﹣1NaHC2O4溶液中c(H C2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
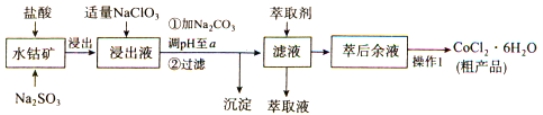
已知:①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
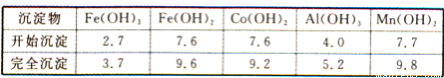
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式:_______________。
(2)若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式:_______________。
(3)“操作1”中包含3个基本实验操作,它们依次是_____________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是_____________。
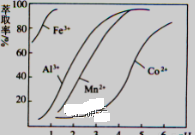
(4)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是____________,其使用的最佳pH范围是______。
A 2.0~2.5 B 3.0~3.5 C 4.0~4.5 D 5.0~5.5
(注:横坐标依次为1-6;单位:PH)
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是__________。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1)向Na2S2O3溶液中加入稀硫酸。_______________
(2)含有KI、H2SO4和淀粉的溶液,通入氧气后溶液变蓝__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法, 错误的是
A.氢氟酸盛装在细口玻璃瓶中
B.氢氧化钠溶液装在用橡胶塞的试剂瓶中
C.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D.金属钠保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3是一种化工原料,可以通过反应生成一系列物质,如下图所示。
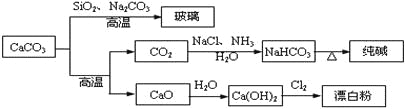
下列说法正确的是( )
A. Cl2和SO2均可以漂白有色物质,且漂白的原理相同
B. 由SiO2+ Na2CO3![]() Na2SiO3+ CO2↑可知H2CO3的酸性强于H2SiO3
Na2SiO3+ CO2↑可知H2CO3的酸性强于H2SiO3
C. 工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3
D. 制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com