
【题目】室温下向10mL0.1molL-1NaOH溶液中加入0.1molL-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA) D. b点所示溶液中c(A-)>c(HA)
【答案】D
【解析】A、a点NaOH与HA物质的量相等,则二者恰好完全反应,生成NaA,反应后溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生水解反应,则溶液中c(Na+)>c(A-)>c(HA)>c(H+),A错误;B、a点NaA发生水解反应,促进了水的电离,b点盐酸过量,抑制水的电离,所以a点水的电离程度大于b点,B错误;C、根据电荷守恒,溶液中存在c(H+)+c(Na+)=c(OH)+c(A-),pH=7时,c(H+)=c(OH),因此溶液中:c(Na+)= c(A-),C错误;D、根据图像可知b点HA过量,因为b点溶液pH=4.7,溶液呈酸性,这说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原子可能处于同一平面
C. x的同分异构体只有y和z两种
D. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
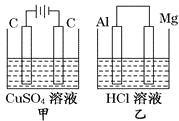
A. 溶液的质量变化:甲减小,乙增大
B. 溶液pH变化:甲减小,乙增大
C. 相同条件下产生气体的体积:V甲=V乙
D. 电极反应式:甲中阴极:Cu2++2e-==Cu,乙中负极:Mg-2e-==Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如图所示:
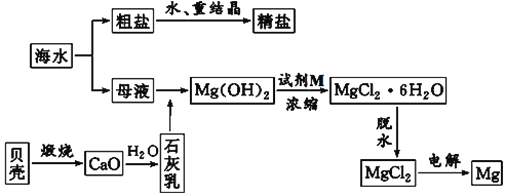
(1)海水提取镁要用到海滩上的贝壳,贝壳煅烧过程中发生反应的化学方程式为___________________________________________。
(2)母液中加入石灰乳反应的离子方程式为______。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:_____________________________,
过滤时:_____________________________,
蒸发时:_____________________________。
(4)除去粗盐溶液中含有的![]() 、
、![]() 、
、![]() ,可依次加入
,可依次加入![]() 溶液、NaOH溶液、________,最后加入_________调节pH至中性。
溶液、NaOH溶液、________,最后加入_________调节pH至中性。
(5)写出金属镁在空气中燃烧的化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,PH相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO-)________ c(HCO3-)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________(填代号)
a.向NaClO溶液中加适量的水 b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水 d. 向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 蛋白质遇浓硫酸变为黄色
B. 油脂为高分子化合物,分子结构中都含有酯基
C. 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,下层析出肥皂
D. 纤维素、麦芽糖在一定条件下均可转化为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A. K+、Na+、CO32-、Cl- B. NH4+、Na 十、Br-、Cu2+
C. Mg2+、Na+、NO3-、SO42- D. Na十、Ba2+、OH-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com