
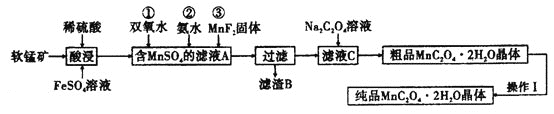
【题目】![]() 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]() 、
、![]() 和
和![]() 制备
制备![]() ,设计流程如图:
,设计流程如图:![]() 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入![]()
已知:常温时部分难溶化合物的![]() 近似值
近似值![]() 如表:
如表:
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)该小组同学在酸浸之前,先将软锰矿粉碎,其目的是________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为________。
发生反应的离子方程式为________。
(3)加入![]() 固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
(4)丙同学认为向滤液C中滴加![]() 溶液的过程中可能会生成
溶液的过程中可能会生成![]() 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为![]() ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数![]() ________
________![]() 填数值
填数值![]() 。
。![]() 已知
已知![]() ,
,![]() 。
。
(5)操作Ⅰ的名称为________。
(6)如图是小组同学将![]() 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度![]() 变化的曲线
变化的曲线![]() 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在![]() 以下不变
以下不变![]() 。
。
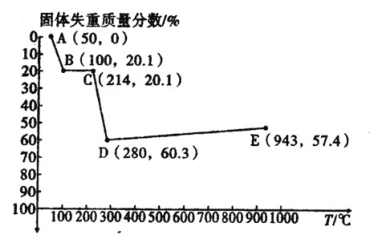
试根据各点的坐标![]() 近似值
近似值![]() 回答下列问题:
回答下列问题:
①![]() 的化学方程式为________。
的化学方程式为________。
②从D点到E点过程中固体失重的质量分数下降的原因是________。
【答案】增大反应物接触面积,加快化学反应速率,使反应物充分反应 ![]() 将
将![]() 转化为更难溶的
转化为更难溶的![]() 而除去
而除去![]() 或除去溶液中的
或除去溶液中的![]() 氢氧化钠溶液能进一步溶解
氢氧化钠溶液能进一步溶解![]() 沉淀,不易控制用量
沉淀,不易控制用量 ![]() 重结晶
重结晶 ![]()
![]() 与空气中的
与空气中的![]() 发生化合反应,生成新的锰的氧化物
发生化合反应,生成新的锰的氧化物
【解析】
用软锰矿(主要成分为MnO2,含少量![]() 、Fe2O3和A12O3等)制备
、Fe2O3和A12O3等)制备![]() :软锰矿用硫酸、硫酸亚铁溶解,酸性条件下二氧化锰被亚铁离子还原为Mn2+,滤液A中加入过氧化氢,将Fe2+氧化为Fe3+,加入氨水调节溶液pH,将Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去,再加入MnF2沉淀钙离子,过滤分离,滤渣中含有氢氧化铁、氢氧化铝和氟化钙,滤液C中加入草酸钠反应生成草酸锰然后分离提纯得到纯净的草酸锰晶体,据此分析解答。
:软锰矿用硫酸、硫酸亚铁溶解,酸性条件下二氧化锰被亚铁离子还原为Mn2+,滤液A中加入过氧化氢,将Fe2+氧化为Fe3+,加入氨水调节溶液pH,将Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去,再加入MnF2沉淀钙离子,过滤分离,滤渣中含有氢氧化铁、氢氧化铝和氟化钙,滤液C中加入草酸钠反应生成草酸锰然后分离提纯得到纯净的草酸锰晶体,据此分析解答。
(1)将软锰矿粉碎能增大固体的表面积,增大固体的表面积可以使固体与溶液充分接触反应,加快反应速率,使反应物充分反应,故答案为:增大反应物接触面积,加快化学反应速率,使反应物充分反应;
(2)酸性条件下二氧化锰被亚铁离子还原为Mn2+,亚铁离子被氧化为铁离子,反应的离子方程式为:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O;
(3)加入![]() 固体的作用是将
固体的作用是将![]() 转化为更难溶的
转化为更难溶的![]() 而除去
而除去![]() 或除去溶液中的
或除去溶液中的![]() ;氢氧化钠溶液能进一步溶解
;氢氧化钠溶液能进一步溶解![]() 沉淀,不易控制用量,因此甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,故答案为:将
沉淀,不易控制用量,因此甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,故答案为:将![]() 转化为更难溶的
转化为更难溶的![]() 而除去
而除去![]() 或除去溶液中的;氢氧化钠溶液能进一步溶解
或除去溶液中的;氢氧化钠溶液能进一步溶解![]() 沉淀,不易控制用量;
沉淀,不易控制用量;
(4)已知![]() ,
,![]() ,常温时,
,常温时,![]() 反应的平衡常数
反应的平衡常数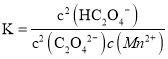 =
=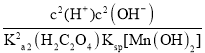 =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(5)操作Ⅰ是分离提纯![]() 粗品,所以该步骤的名称为重结晶,故答案为:重结晶;
粗品,所以该步骤的名称为重结晶,故答案为:重结晶;
(6)①MnC2O42H2O的摩尔质量为179g/mol,假设1molMnC2O42H2O发生分解,则C点失重:179g×0.201g≈36g,即恰好失去水分子,C点固体为MnC2O4,D点失重60.3%,则D点质量为:179g×(1-60.3%)≈71g,则D点为MnO,C~D的化学方程式为:MnC2O4 ![]() MnO+CO↑+CO2↑,故答案为:MnC2O4
MnO+CO↑+CO2↑,故答案为:MnC2O4 ![]() MnO+CO↑+CO2↑;
MnO+CO↑+CO2↑;
②由于MnO与空气中氧气发生化合反应生成新的锰的氧化物,导致从D到E点过程中固体失重的质量分数下降,故答案为:MnO与空气中O2发生化合反应,生成新的锰的氧化物。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g) ![]() 2Z(g),有关下列图像说法正确的是
2Z(g),有关下列图像说法正确的是
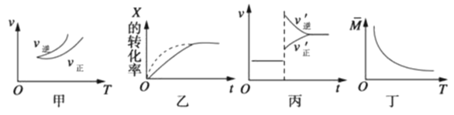
A.依据图甲可判断正反应为吸热反应
B.在图乙中,虚线可表示压强增大
C.若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“摇头丸”是毒品中的一种,其中含有国家监管的药品——氯胺酮,它有致幻作用,在一定条件下发生一系列转化:
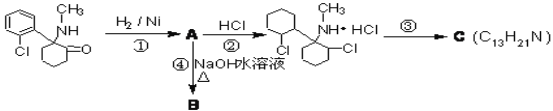
(1)氯胺酮中含氧官能团名称为__________,上述转化过程中发生加成反应的是_____(填序号)
(2)反应③的条件__________,C的结构有两种,其中一种结构只含有一个手性碳原子(连接四个不同原子或原子团的碳原子叫手性碳原子),其结构简式为__________
(3)步骤④的化学反应方程式_____________________________________________
(4)有一种去甲基氯胺酮D,能发生如下反应:(已知:琥珀醛酸的分子式为C4H6O3)

①由E→F的转化过程中,氰基硼氢化钠所体现的性质为_____________________
②H的分子式为_______________________
③M的分子式为C10H10O3 ,符合下列条件的同分异构体有___________种
i与琥珀醛酸具有相同官能团 ii含苯环且苯环上有两个取代基
④N是与琥珀醛酸具有相同官能团一种同分异构体,以N为主要原料合成 ___________
___________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典ASES公司设计的曾用于驱动潜艇的液氨﹣液氧燃料电池如图所示,该燃料电池工作时,负极的电极反应式为________;电池的总反应为________
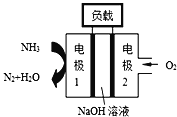
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.

②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
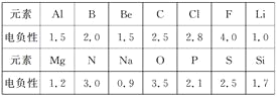
①判断下列化合物中属于离子化合物的是________(填字母);
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为__________________________;NCl3水解产物为____________________。
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:
![]()
①铍的最高价氧化物的水化物是________(填“酸性”、“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________________________________;
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为__________(用化学式表示)。
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
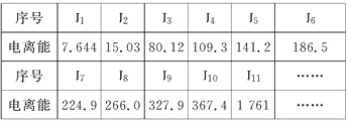
①外层电子离核越远,能量越高,电离能越__________(填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越________(填“大”或“小”);
②上述11个电子分属________个电子层;
③失去了11个电子后,该元素还有________个电子;
④该元素最高价氧化物对应水化物的化学式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒钢具有高强度、弹性优良、抗磨损、抗冲击等性能,可用于汽车和飞机制造。一种从石煤(含SiO2、V2O3、V2O5和少量Fe2O3)中提取V2O5的流程如下图所示:
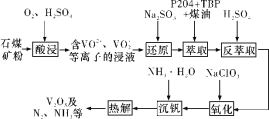
已知:
VO2+ | VO2+ | Fe2+ | Fe3+ | |
P2O4+TBP+煤油中的溶解度 | 很大 | 较小 | 0 | 很大 |
请回答下列问题:
(1)“酸浸”时,为提高浸出速率,除适当增加硫酸浓度、减小石煤矿粉粒径外,还可采取的措施有__________(任写一条);生成VO2+反应的离子方程式为_______。
(2)从整个流程来看,“还原”的目的为_______。
(3)实验室模拟“萃取”时,需用到的玻璃仪器有____________。
(4)“氧化”时发生反应的离子方程式为__________。
(5)上述流程中可以循环利用的物质有_________。
(6)全钒液流储能电池的工作原理为VO2++V3++H2O![]() VO2++V2++2H+。
VO2++V2++2H+。
①充电时,阳极的电极反应式为______;
②两极区被质子交换膜隔开,放电时,若外电路转移2mole-,则正极区溶液中n(H+)________(填“增加”或“减少”)________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
(1)已知:2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1。则4NH3(g)+3O2(g)
2H2O(g) ΔH=-483.6 kJ·mol-1。则4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=______kJ·mol-1。
2N2(g)+6H2O(g) ΔH=______kJ·mol-1。
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=__kJ·mol-1;使用催化剂之后,正反应的活化能为___kJ·mol-1(已知:加入催化剂后,反应分两步进行,反应的活化能是两个过程中需要吸收能量较大的反应的活化能)。
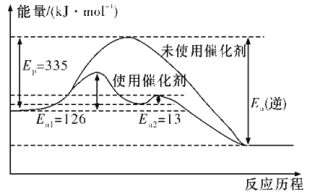
(3)从平衡视角考虑,工业合成氨应该选择常温条件,但实际工业生产却选择500 ℃左右的高温,试解释其原因: ____________________________。
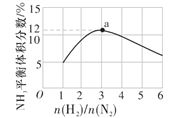
(4)如图表示500 ℃、60 MPa条件下,原料气投料比与平衡时NH3的体积分数的关系。根据图中a点数据计算N2的平衡体积分数为__。
(5)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是__(填“A”“B”或“C”),理由是________。
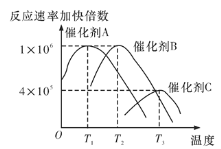
(6)如图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
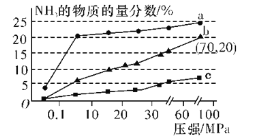
①曲线a、b对应温度较高的是___(填“a”或“b”)。
②列出b点平衡常数的计算式Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;不要求计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com