
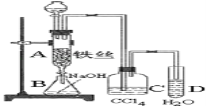
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式___。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___,写出有关反应的离子方程式____。
(3)C中盛放CCl4的作用是____。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___,现象是____。
【答案】C6H6+Br2![]() C6H5Br+HBr 除去溶于溴苯中的溴 Br2+2OH-=Br-+BrO-+H2O 除去溴化氢气体中的溴蒸气 石蕊试液 溶液变红色
C6H5Br+HBr 除去溶于溴苯中的溴 Br2+2OH-=Br-+BrO-+H2O 除去溴化氢气体中的溴蒸气 石蕊试液 溶液变红色
【解析】
苯和液溴在铁作催化剂作用下反应生成溴苯和溴化氢,生成的溴苯中混合溴单质,将反应后的液体放入到氢氧化钠溶液中除掉溴单质,制溴苯反应是放热反应,生成HBr同时由于溴易挥发,因此HBr和溴蒸汽进入到后面装置中,将有机溶剂萃取溴单质,HBr溶于水电离出氢离子和溴离子,用紫色石蕊或硝酸银来验证。
⑴A中是苯和液溴在铁作催化剂作用下反应生成溴苯和溴化氢,其反应的化学方程式C6H6 + Br2![]() C6H5Br+HBr;故答案为:C6H6+Br2
C6H5Br+HBr;故答案为:C6H6+Br2![]() C6H5Br+HBr。
C6H5Br+HBr。
⑵实验结束时,打开A下端的活塞,反应液中含有未反应完的溴单质,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,氢氧化钠和溴单质反应生成溴化钠、次溴酸钠和水,其反应的离子方程式Br2+2OH- = Br-+BrO-+H2O;故答案为:除去溶于溴苯中的溴;Br2+2OH- = Br-+BrO-+H2O。
⑶为了验证发生取代反应,因此生成溴化氢同时还有溴蒸汽进入到后面装置中,因此C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气;故答案为:除去溴化氢气体中的溴蒸气。
⑷能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法利用HBr溶于水溶液显酸性,用紫色石蕊来验证,因此是向试管D中加入石蕊试液,现象是溶液变红色;故答案为:石蕊试液;溶液变红色。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
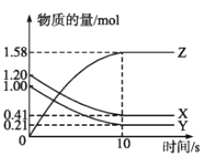
(1)写出该反应的化学方程式_________________________。
(2)计算反应开始到10s,用X表示的反应速率是___________。
(3)下列叙述中能说明上述反应达到平衡状态的是_________。
a.当X与Y的反应速率之比为1:1
b.混合气体中X的浓度保持不变
c.X、Y、Z的浓度之比为1:1:2
(4)为使该反应的反应速率增大,可采取的措施是_______。
a.适当降低温度 b.扩大容器的体积 c.充入一定量Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:_______________________。
②乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是________。
③丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入少量NH4Cl晶体,颜色变______(填“深”或“浅”)。你认为证明氨水是弱碱的原因是_____________。
④请你根据所提供的试剂,再提出一个合理简便的方案证明NH3·H2O是弱电解质:_________。
(2)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示,请回答下列问题:
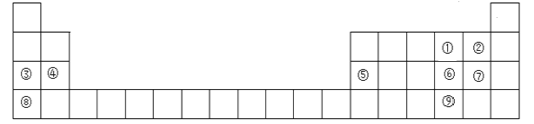
(1)元素⑨在周期表中的位置是_______。
(2)元素①~⑨中,非金属性最强的元素是_______(填元素符号)。
(3)元素①~⑨中,最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),它与元素⑤的最高价氧化物对应水化物反应的离子方程式为_______。
(4)元素⑨的简单氢化物与元素⑦的简单氢化物中更稳定的是_______(填化学式)。
(5)元素③与元素①形成的淡黄色化合物的电子式为_______。
(6)元素①的简单氢化物比元素⑥的简单氢化物的沸点_______(填“高”或“低”),原因是_______。
(7)元素④与元素⑦形成的化合物是_______(填“离子”或“共价”)化合物,用电子式表示其形成过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(s)+3B(g)![]() 2C(g)+D(g),2min后,C的浓度增加0.4mol/L。下列关于该化学反应的说法不正确的是( )
2C(g)+D(g),2min后,C的浓度增加0.4mol/L。下列关于该化学反应的说法不正确的是( )
A.2min末,气体D在标准状况下的体积无法计算
B.用物质B、C、D来分别表示该反应的速率之比为3:2:1
C.由于A为纯固体,物质的量浓度是常数,故无法利用A的相关物理量的变化来表示该反应的速率大小
D.单位时间内,每消耗0.3molB气体,同时消耗0.1molD气体,此时该反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新型能源。
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=﹣99kJ·mol-1
CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=﹣41kJ·mol-1
CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式_____。
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是____(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变
b.△H3保持不变
c.![]() 保持不变
保持不变
d.气体密度保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3 的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①该温度下,上述反应的平衡常数K为___(用分数表示)。
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,![]() 只与温度有关。15min时,=___(结果保留2位小数)。
只与温度有关。15min时,=___(结果保留2位小数)。
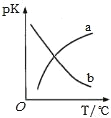
(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线___(填“a”或“b”)能反映平衡常数变化趋势。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是( )

A. 测量原理示意图中,电流方向从Cu流向Ag2O
B. 负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C. 电池工作时,OH-向正极移动
D. 2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com