
【题目】I.常温常压下,一氧化二氯(Cl2O)为棕黄色气体。沸点为3.8℃,当温度高于42℃时,分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。将氯气和空气(不参与反应)按照体积比1:3混合后,通入含水量为8%(质量分数)的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)仪器a的名称是 ________________。
(2)上述装置合理的连接顺序为 ___ →___ →___ → C →___ →(填装置下方的大写字母)。
(3)反应过程中装置B需要放在冷水中,其目的是________________________________。
(4)装置C的作用 __________________________________。
(5)制备Cl2O的化学方程式____________________________________________。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点主要为_________________。
II.(7)探究NO与Na2O2反应的产物。
假设1:产物只有NaNO2;
假设2:__________;
假设3:产物为NaNO3和NaNO2的混合物。
为验证反应产物,该小组同学准确称取反应后的固体3.50 g,用煮沸并冷却后的蒸馏水配成100.00 mL溶液,取10.00 mL溶液于锥形瓶中,用0.200 0 mol·L-1KMnO4溶液(硫酸酸化)滴定,共消耗KMnO4溶液10 mL。滴定过程中发生反应的离子方程式为_______________,反应产物中NaNO2的质量分数为_________(保留四位有效数字)。
【答案】三颈烧瓶 A D B E 防止反应放热后温度过高导致Cl2O分解 除去Cl2O中的Cl2 2Cl2 + Na2CO3=Cl2O + 2NaCl + CO2或2Cl2 + Na2CO3 + H2O =Cl2O + 2NaCl +H2 CO3或2Cl2 + Na2CO3 + H2O =Cl2O + 2NaCl +NaHCO3 制得的次氯酸溶液纯度较高(浓度较大) 产物只有NaNO3 2MnO4—+5NO2—+6H+=5NO3—![]() +2Mn2++3H2O 98.57%
+2Mn2++3H2O 98.57%
【解析】
I.根据实验目的,要将Cl2和空气混合通入含Na2CO3溶液中制备Cl2O ,应先用装置A制备Cl2,再通过装置D除去混合气体中的HCl气体,同时混入空气,将混合气体通入装置B,在装置B中发生制备Cl2O 的反应;然后将制取的Cl2O气体先通入装置C,以除去Cl2杂质气体,最后通过装置E制取次氯酸溶液。
II.由化合价变化可知,NO与Na2O2反应可能生成NaNO2或NaNO3或NaNO3和NaNO2的混合物;NaNO2中N元素为+3价,能被酸性KMnO4溶液氧化为NaNO3,根据方程式和题给数据计算反应产物中NaNO2的质量分数。
I.(1)仪器a的名称是三颈烧瓶,故答案为:三颈烧瓶;
(2)根据实验目的,要将Cl2和空气混合通入含Na2CO3溶液中制备Cl2O ,应先用装置A制备Cl2,再通过装置D除去混合气体中的HCl气体,同时混入空气,将混合气体通入装置B,在装置B中发生制备Cl2O 的反应;然后将制取的Cl2O气体先通入装置C,以除去Cl2杂质气体,最后通过装置E制取次氯酸溶液,故装置的连接顺序为A、D、B、C、E,故答案为:A;D;B;E;
(3)已知Cl2O 在42℃以上会分解生成Cl2和O2,因此反应过程中,装置B需放在冷水中,防止反应放热后温度过高导致Cl2O分解,故答案为:防止反应放热后温度过高导致 Cl2O 分解;
(4)氯气属于非极性分子,易溶于非极性的有机溶剂四氯化碳,所以装置 C 的作用是除去 Cl2O 中的Cl2,故答案为:除去 Cl2O 中的 Cl2;
(5)氯气与碳酸钠溶液发生歧化反应,其中氯元素从0价变为+1价和-1价,生成Cl2O和NaCl,反应的方程式为:2Cl2+Na2CO3=Cl2O+2NaCl+CO2(或 2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3),故答案为:2Cl2+Na2CO3=Cl2O+2NaCl+CO2(或 2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3);
(6)氯气直接溶于水反应生成盐酸和次氯酸的反应为可逆反应,制备的次氯酸浓度较低,并且有盐酸杂质,而用此方法制备次氯酸溶液纯度较高、浓度较大,故答案为:制得的次氯酸溶液纯度较高(浓度较大);
II.(7)由化合价变化可知,NO与Na2O2反应可能生成NaNO2或NaNO3或NaNO3和NaNO2的混合物,故答案为:NaNO3;
NaNO2中N元素为+3价,能被酸性KMnO4溶液氧化为NaNO3,离子反应为2MnO4-+5NO2-+6H+
=5NO3-+2Mn2++3H2O,滴定过程中消耗KMnO4的物质的量是2×10-3mol,根据方程式可知参加反应的NaNO2的物质的量为5×10-3mol,质量为5×10-3mol×69g/mol=0.345g,被滴定的10mL溶液中含有0.35g反应后的固体,则反应产物中NaNO2的质量分数为0.345g÷0.35g
×100%=98.57%,故答案为:2MnO4-+5NO2-+6H+=5NO3-+2Mn2++3H2O;98.57%。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)![]() 2HI(g)的说法,不正确的是 ( )
2HI(g)的说法,不正确的是 ( )
A.放热反应B.吸热反应C.化合反应D.可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)2HI(g)△H=-9.48kJmol-1
②H2(g)+I2(?)2HI(g)△H=+26.48kJmol-1
下列判断不正确的是( )
A.![]() 中的I2为气态,
中的I2为气态,![]() 中的I2为固态
中的I2为固态
B.![]() 的反应物总能量比
的反应物总能量比![]() 的反应总能量低
的反应总能量低
C.1mol固态碘升华时将吸热35.96kJ
D.反应![]() 的产物比反应
的产物比反应![]() 的产物热稳定性更好
的产物热稳定性更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、HCO3、NO3 B.NH4+、SO42、Al3+、NO3
C.Na+、Ca2+、NO3、CO32 D.K+、MnO4、NH4+、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,22.4LCHCl3中含有的分子数为NA
B. 1L 0.1mol·L-1的NaHS溶液中HS-和S2-离子数之和为0.1NA
C. 白磷结构如图所示,12.4g白磷中所包含的P—P共价键有0.6NA

D. 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.NO是第一个被发现的生命体系气体信号分子,具有舒张血管的功能。工业上可用“氨催化氧化法”生产NO,主要副产物为N2。请回答下列问题:
(1)以氨气、氧气为原料,在催化剂存在下生成NO和副产物N2的热化学方程式如下:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)
4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)
2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)![]() 2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
(2)某化学研究性学习小组模拟工业合成NO的反应。在1110K时,向一恒容密闭容器内充入1mol NH3和2.8mol O2,加入合适催化剂(催化剂的体积大小可忽略不计),保持温度不变,只发生反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①下列各项能说明反应已达到化学平衡状态的是_______。(填字母序号)
a.5c(NH3)=4c(O2)
b.N-H键的生成速率与O-H键的生成速率相等
c.混合气体的压强不变
d.混合气体的密度不变
②若其他条件不变,将容器改为恒容的绝热容器,在达到平衡后的体系温度下的化学平衡常数为K1,则K1_____K(填“>”、“<”或“=”)。
II.(3)某化学研究性学习小组模拟用CO和H2合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_______,该温度下平衡常数K=_______。
III.(4)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极上的电极反应式为_____________。
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到5.6 L(标准状况)气体时,消耗甲烷的体积为________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)。
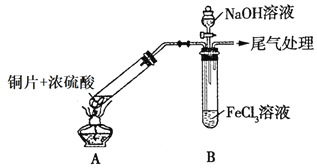
(1)图中盛放NaOH溶液的玻璃仪器名称是______。
(2)实验前,应先检查装置的______;实验开始后,A装置中试管内发生反应的化学方程式为______。实验中产生尾气可通入______(填写化学试剂)进行吸收处理。
(3)B试管中装有5mL1molL-1FeCl3溶液,往其中通入足量的SO2气体,B试管中的实验现象为______,写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A. 非电解质:氨气、酒精、氯气
B. 混合物:盐酸、碱石灰、纯牛奶
C. 碱:烧碱、纯碱、氢氧化钡
D. 酸性氧化物:CO2、SiO2、Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25 mol·L-1 Al2(SO4)3溶液与0.5 mol·L-1 Na2CO3溶液的反应,实验如下。下列分析错误的是
实验1 |
|
实验2 |
|
A. 实验1中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b中含有CO![]()
C. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
D. 实验1、2中,白色沉淀成分不同可能与混合后溶液的pH有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com