
【题目】铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:
![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
温度/℃ | 1000 | 1115 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=______;Q______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=______;
(3)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________、____________;
4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________、____________;
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如下图所示:
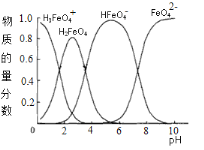
(i)pH=2时溶液存在如下等量关系: c(K+)=_____________;
(ii)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为_________。
【答案】![]() > > 0.006 mol/(Lmin) 杀菌消毒 净水(吸附悬浮物) 2c(H2FeO4)+2 c(H3FeO4+)+2 c(HFeO4-) HFeO4-+OH-→ FeO42-+H2O
> > 0.006 mol/(Lmin) 杀菌消毒 净水(吸附悬浮物) 2c(H2FeO4)+2 c(H3FeO4+)+2 c(HFeO4-) HFeO4-+OH-→ FeO42-+H2O
【解析】
(1)根据平衡常数表达式分析解答;
(2)运用三段式法根据平衡移动原理进行分析解答;
(3)根据物质性质及净水原理分析解答;
(4)根据物料守恒及图示中离子存在信息分析解答。
(1)K为生成物浓度幂之积与反应物浓度幂之积的比,纯固体不能列入表达式中,则K=![]() ,由表格数据可知,温度越高,K越小,反应为放热反应,则Q>0,故答案为:
,由表格数据可知,温度越高,K越小,反应为放热反应,则Q>0,故答案为:![]() ;>;
;>;
(2)1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,Qc=![]() =1<K=4.0,平衡正向移动,则此时υ正>υ逆;
=1<K=4.0,平衡正向移动,则此时υ正>υ逆;
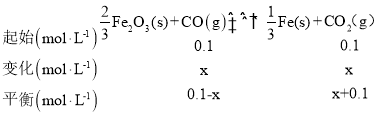
则![]() ,解得x=0.06mol/L, v(CO2)=
,解得x=0.06mol/L, v(CO2)=![]() ,故答案为:>:0.006 mol/(Lmin);
,故答案为:>:0.006 mol/(Lmin);
(3)K2FeO4具有强氧化性,还原产物铁离子水解生成胶体,则净化水时的作用为杀菌消毒、净水(吸附悬浮物),故答案为:杀菌消毒;净水(吸附悬浮物);
(4)(i)pH=2时,K2FeO4溶液中离子为H3FeO4+、HFeO4-,还存在H2FeO4,由物料守恒可知,c(K+)=2c(H2FeO4)+2 c(H3FeO4+)+2 c(HFeO4-),故答案为:2c(H2FeO4)+2 c(H3FeO4+)+2 c(HFeO4-);
(ii)pH=6的溶液中加入KOH溶液,KOH与HFeO4-反应,离子方程式为:HFeO4-+OH-= FeO42-+H2O,故答案为: HFeO4-+OH-= FeO42-+H2O。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是
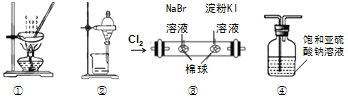
A.图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.图②所示装置,分离CCl4萃取I2水后的有机层
C.图③所示装置,证明氧化性:Cl2>Br2>I2
D.图④所示装置,除去SO2中混有的少量HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用食盐水制取ClO2的工业流程如图所示。

装置①中的反应:![]()
装置②中的反应:![]()
下列关于该流程的说法正确的是
A.该流程中仅NaCl可循环利用
B.装置①中H2是阴极产物
C.装置②中Cl2是还原产物
D.为使H2完全转化为HCl,还应向装置③中再补充Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
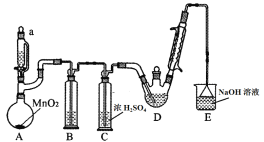
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
①制备反应原理: C2H5OH + 4Cl2→CCl3CHO+5HCl
可能发生的副反应:
C2H5OH + HCl→C2H5Cl+H2O
CCl3CHO + HClO→CCl3COOH (三氯乙酸) +HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)装置B中盛放的试剂是___________;装置E的作用是_______;
(2)若撤去装置C,可能导致装置D中副产物________(填化学式)的量增加;装置D可采用________加热的方法以控制反应温度在70℃左右。
(3)反应结束后,可采用_________的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有_________。
(4)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol/L碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200 mol/LNa2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为____。(保留3位有效数字)
滴定的反应原理:CCl3CHO +OH—→CHCl3 + HCOO- HCOO-+ I2 → H+ + 2I-+ CO2↑ I2 + 2S2O32-→2I- + S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如下图所示,下列说法正确的是
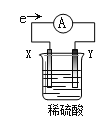
A.外电路的电流方向为:X→外电路→Y
B.X极上发生的是还原反应
C.溶液中氢离子向X极移动
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol/L H2SO4溶液中,乙同学将电极放入6 mol/L的NaOH溶液中,如上图所示。请回答:
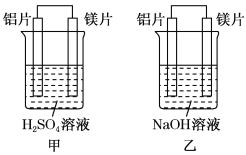
(1)写出甲池中负极的电极反应式:____________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极_________________总反应的离子方程式为________________________。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出_________活动性更强,而乙会判断出_________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?_______________________________(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”,这种做法___________________ (填“可靠”或“不可靠”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com