
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是
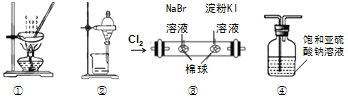
A.图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.图②所示装置,分离CCl4萃取I2水后的有机层
C.图③所示装置,证明氧化性:Cl2>Br2>I2
D.图④所示装置,除去SO2中混有的少量HCl气体
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛.将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O35H2O(大苏打).
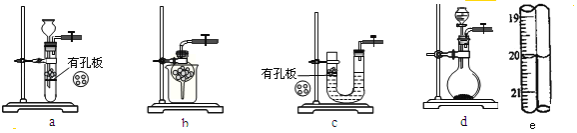
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是_____(选填编号);检查该装置气密性的操作是:关闭止水夹,再_______________。
(2)在Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为________________(生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为__________________(生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为_______________(生成的盐为酸式盐)。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为_________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是_________。
(4)硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32﹣+I3﹣=S4O62﹣+3I﹣.
①为保证不变质,配制硫代硫酸钠溶液须用新煮沸并冷却的蒸馏水,其理由是___________。
②取2.500g含杂质的Na2S2O35H2O晶体配成50mL溶液,每次取10.00mL用0.0500mol/L KI3溶液滴定(以淀粉为指示剂),实验数据如下(第3次初读数为0.00,终点读数如图e;杂质不参加反应):
编号 | 1 | 2 | 3 |
消耗KI3溶液的体积/mL | 19.98 | 20.02 |
到达滴定终点的现象是_______________;Na2S2O35H2O(式量248)的质量分数是(保留4位小数)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率v(N2)=____________;
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是_______;
A. 选用更有效的催化剂 B. 升高反应体系的温度
C. 降低反应体系的温度 D. 缩小容器的体积
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中;请在下表空格中填入剩余的实验条件数据。
实验 编号 | T/℃ | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | __________ | __________ | __________ | 124 |
Ⅲ | 350 | ________ | ____________ | 124 |
(4)请画出题表中的三个实验条件下混合气体中CO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。______________
(5)消除一氧化氮可以用在水的存在下通入氧气加以除去。现将标准状况下的一试管一氧化氮气体倒置于水中,慢慢通入氧气,溶液充满整个试管,若不考虑溶质的扩散,则试管内稀硝酸的浓度为_________mol/L;若继续通入氧气,将试管内溶液排除一半,则剩余稀硝酸的浓度为__________mol/L。
(6)利用氨气的还原性也可以除去氮氧化合物(NOx),当氨气与NOx等物质的量恰好反应生成氮气和水,则x=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。
(1)饱和食盐水所用的原料粗盐主要来自于海洋,从海水中得到粗盐我们通常用的方法是_______。
(2)所得的粗盐(含Ca2+、Mg2+、SO42-)需要提纯,需要加入足量NaOH、BaCl2、Na2CO3溶液将杂质离子除去,随后过滤并加入盐酸调pH至7。其中先用BaCl2,再用Na2CO3的原因是______。
(3)饱和食盐水除用于制纯碱,也是氯碱工业的原料。氯碱工业中电解饱和食盐水的方程式为_______。
(4)测试纯碱产品中NaHCO3含量的方法是:用_______(定量仪器)称取纯碱样品1.144g,用蒸馏水溶解,加入0.500mol/L的HCl溶液100mL,再加1-2滴酚酞,继续用0.500mol/L标准氢氧化钠溶液滴定。当滴定至溶液由_____色变_____色,半分钟不变色为滴定终点。
(5)若上述过程中共消耗氢氧化钠58.00mL,纯碱样品中NaHCO3质量分数为_____。(保留3位小数)
(6)如果装氢氧化钠的滴定管滴定结束读数时有漏液情况,会导致测定结果______(选填“偏大”、“偏 小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种塑料抗氧化剂C可通过下列反应合成:
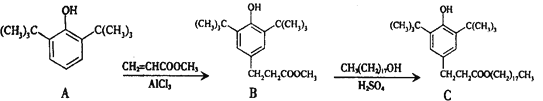
下列有关叙述正确的是
A.物质A是苯甲醇的同系物
B.物质B能发生取代、加聚等反应
C.可用氯化铁溶液鉴别物质C中是否含有CH3(CH2)17OH杂质
D.1 mol物质C与足量NaOH溶液反应,最多可消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫(S2C12)的结构式为Cl—S—S—Cl,常温下为浅黄色油状液体,遇水即分解:2S2Cl2+2H2O→4HCl+SO2↑+3S↓。下列有关此反应的说法正确的是
A.S2C12做氧化剂,H2O做还原剂
B.每生成l mol SO2转移4 mol电子
C.氧化产物与还原产物的物质的量之比为l:3
D.每生成48g硫会断裂2mol氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:
![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
温度/℃ | 1000 | 1115 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=______;Q______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=______;
(3)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________、____________;
4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________、____________;
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如下图所示:
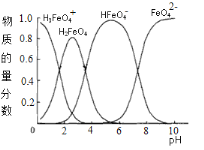
(i)pH=2时溶液存在如下等量关系: c(K+)=_____________;
(ii)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是造成空气污染的主要原因之一。可以用Na2SO3溶液为吸收液除SO2。
(1)反应的离子方程式是___________。
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:_________________。
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是___________________。
(4)往Na2SO3稀溶液中加入少量KOH固体完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+):c(SO32-)的比值________(填“变大”、“变小”或“保持不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
NaNO3 | KNO3 | NaCl | KCl | |
10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
100℃ | 175 | 246 | 39.1 | 56.6 |
用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示
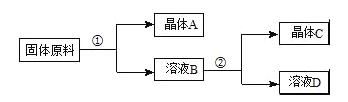
以下说法错误的是( )
A.①和②的实验过程中,都需要控制温度
B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
D.用95%的酒精洗涤所得的硝酸钾晶体比较好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com