
【题目】SO2是造成空气污染的主要原因之一。可以用Na2SO3溶液为吸收液除SO2。
(1)反应的离子方程式是___________。
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:_________________。
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是___________________。
(4)往Na2SO3稀溶液中加入少量KOH固体完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+):c(SO32-)的比值________(填“变大”、“变小”或“保持不变”)。
【答案】SO32-+SO2+H2O=2HSO3- 在亚硫酸氢钠溶液中HSO3-存在电离平衡:HSO3-![]() SO32-+H+和水解平衡HSO3-+H2O
SO32-+H+和水解平衡HSO3-+H2O![]() H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 变小
H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 变小
【解析】
(1)Na2SO3溶液吸收SO2能生成亚硫酸氢钠;
(2)HSO3-在溶液中既能电离出氢离子,同时HSO3-也能水解生成氢氧根,由于HSO3-的电离程度大于水解程度,所以溶液显酸性;
(3)先写出Na2SO3稀溶液中的所有的电离、水解方程式,比较电离和水解程度的大小,进而比较离子的大小顺序;
(4)利用水解平衡移动进行分析。
(1)Na2SO3溶液吸收SO2能生成亚硫酸氢钠,反应的离子方程式是SO32- + SO2 + H2O = 2HSO3-,故答案为:SO32- + SO2 + H2O = 2HSO3-;
(2)HSO3-在溶液中既能电离出氢离子HSO3- H+ + SO32-,同时HSO3-也能水解生成氢氧根, HSO3- + H2O OH- + H2SO3,由于HSO3-的电离程度大于水解程度,所以溶液显酸性,故答案为:在亚硫酸氢钠溶液中HSO3-在溶液中既能电离出氢离子,HSO3- H+ + SO32-,同时HSO3-也能水解生成氢氧根,HSO3- + H2O OH- + H2SO3,由于HSO3-的电离程度大于水解程度,所以溶液显酸性;
(3)在Na2SO3稀溶液中,按电离和水解程度的大小顺序依次排列为:Na2SO3 = 2Na+ + SO32-;SO32- + H2O OH- + HSO3-;HSO3- + H2O OH- + H2SO3,H2O OH- + H+,则Na2SO3稀溶液中各离子浓度从大到小排列顺序是c(Na+)> c(SO32-)> c(OH-)> c(HSO3-)> c(H+),故答案为:c(Na+)> c(SO32-)> c(OH-)> c(HSO3-)> c(H+);
(4)在Na2SO3稀溶液中存在SO32-的水解平衡:SO32- + H2O OH- + HSO3-,当加入少量KOH固体后,c(OH-)增大,平衡逆向移动,c(SO32-)增大,c(Na+)不变,则c(Na+) : c(SO32-) 的比值变小,故答案为:变小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法中不正确的是( )
A.向0.1molL-1CH3COOH溶液中加入少量水,溶液中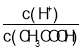 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 减小
减小
C.向盐酸中加入氨水至中性,溶液中![]() =1
=1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是
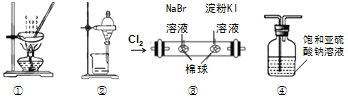
A.图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.图②所示装置,分离CCl4萃取I2水后的有机层
C.图③所示装置,证明氧化性:Cl2>Br2>I2
D.图④所示装置,除去SO2中混有的少量HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
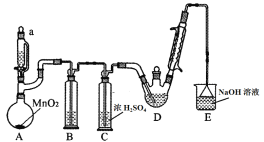
①制备反应原理: C2H5OH + 4Cl2→CCl3CHO+5HCl
可能发生的副反应:
C2H5OH + HCl→C2H5Cl+H2O
CCl3CHO + HClO→CCl3COOH (三氯乙酸) +HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)装置B中盛放的试剂是___________;装置E的作用是_______;
(2)若撤去装置C,可能导致装置D中副产物________(填化学式)的量增加;装置D可采用________加热的方法以控制反应温度在70℃左右。
(3)反应结束后,可采用_________的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有_________。
(4)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol/L碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200 mol/LNa2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为____。(保留3位有效数字)
滴定的反应原理:CCl3CHO +OH—→CHCl3 + HCOO- HCOO-+ I2 → H+ + 2I-+ CO2↑ I2 + 2S2O32-→2I- + S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如下图所示,下列说法正确的是
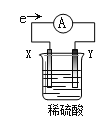
A.外电路的电流方向为:X→外电路→Y
B.X极上发生的是还原反应
C.溶液中氢离子向X极移动
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三个热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A. -488.3 kJ/mol B. +488.3 kJ/mol
C. -2 228.9 kJ/mol D. +191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:___。
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___,其中氮元素原子最外层电子排布的轨道表示式是___,通过比较___可判断氮、磷两种元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是___。
(5)CS2熔点高于CO2,其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL0.1molL-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1molL-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法正确的( )
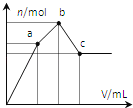
A.a点的溶液呈中性
B.a点沉淀的质量比c点沉淀的质量大
C.b点加入Ba(OH)2溶液的体积为250mL
D.至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-→AlO2-+2BaSO4↓+NH3H2O+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com