
【题目】目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率v(N2)=____________;
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是_______;
A. 选用更有效的催化剂 B. 升高反应体系的温度
C. 降低反应体系的温度 D. 缩小容器的体积
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中;请在下表空格中填入剩余的实验条件数据。
实验 编号 | T/℃ | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | __________ | __________ | __________ | 124 |
Ⅲ | 350 | ________ | ____________ | 124 |
(4)请画出题表中的三个实验条件下混合气体中CO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。______________
(5)消除一氧化氮可以用在水的存在下通入氧气加以除去。现将标准状况下的一试管一氧化氮气体倒置于水中,慢慢通入氧气,溶液充满整个试管,若不考虑溶质的扩散,则试管内稀硝酸的浓度为_________mol/L;若继续通入氧气,将试管内溶液排除一半,则剩余稀硝酸的浓度为__________mol/L。
(6)利用氨气的还原性也可以除去氮氧化合物(NOx),当氨气与NOx等物质的量恰好反应生成氮气和水,则x=_________。
【答案】1.875×10-4 mol/(Ls) CD 280 1.20×10-3 5.80×10-3 1.20×10-3 5.80×10-3 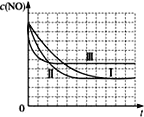 0.045 0.045 1.5
0.045 0.045 1.5
【解析】
(1)依据化学反应速率的概念结合图表数据分析计算一氧化氮的反应速率,结合速率之比等于系数之比;
(2)提高NO转化率,平衡正向进行;
(3)根据实验目的验证温度、催化剂比表面积对化学反应速率的影响规律,则应保证浓度相同,然后相同温度时比较催化剂比表面积,相同催化剂比表面积时比较温度;
(4)利用影响化学反应速率及化学平衡的因素来分析图象,利用影响化学反应速率及化学平衡的因素来分析、完成实验条件下混合气体中NO浓度随时间变化的趋势曲线图;
(5)据原子守恒,NO的物质的量与硝酸的物质的量相同,假设试管体积为V L,可以求算出NO气体的物质的量;充入氧气排出![]() 体积的溶液,剩余溶液浓度不变;
体积的溶液,剩余溶液浓度不变;
(6)依据氧化还原反应中得失电子守恒解答。
(1)前2s内的平均反应速度v(NO)=![]() =3.75×10-4 mol/(Ls),由于用不同物质表示的化学反应速率,速率比等于化学计量数的比,v(N2):v(NO)=1:2,可得到v(N2)=1.875×10-4 mol/(Ls);
=3.75×10-4 mol/(Ls),由于用不同物质表示的化学反应速率,速率比等于化学计量数的比,v(N2):v(NO)=1:2,可得到v(N2)=1.875×10-4 mol/(Ls);
(2)对于反应2NO+2CO![]() 2CO2+N2,该反应的正反应是气体体积减小的放热反应。
2CO2+N2,该反应的正反应是气体体积减小的放热反应。
A. 选用更有效的催化剂,只能改变反应速率,不能改变平衡,A错误;
B. 反应是放热反应,升高反应体系的温度,化学平衡逆向进行,CO的转化率减小,B错误;
C. 反应是放热反应,降低反应体系的温度,平衡正向进行,CO转化率增大,C正确;
D. 缩小容器的体积,压强增大,平衡向气体体积减小的方向进行,平衡正向进行,CO转化率增大,D正确;
故合理选项是CD;
(3)因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有物质的浓度应控制相同来验证催化剂比表面积对速率的影响;故反应条件:温度T=280℃;c(NO)= 1.20×10-3 mol/L;c(CO)=5.80×10-3 mol/L;
Ⅱ、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响;,
故反应条件:c(NO)= 1.20×10-3 mol/L;c(CO)=5.80×10-3 mol/L;
(4)因Ⅰ、Ⅱ温度相同,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,Ⅰ、Ⅱ达平衡时NO的浓度相同,NO起始浓度为1.20×10-3 mol/L;Ⅰ、Ⅱ与Ⅲ的起始浓度相同,Ⅲ催化剂的比表面积等于Ⅱ大于Ⅰ,温度高于Ⅰ和Ⅱ,反应放热,升温时NO转化率降低,达到平衡所用时间短,所以表中的Ⅰ、Ⅱ、Ⅲ三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为: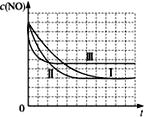 ;
;
(5)据原子守恒,NO的物质的量与硝酸的物质的量相同,假设试管体积为V L,则n(NO)=n(HNO3)=![]() mol,溶液充满整个试管,则硝酸溶液的体积为V L,则硝酸溶液的浓度c(HNO3)
mol,溶液充满整个试管,则硝酸溶液的体积为V L,则硝酸溶液的浓度c(HNO3)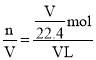 =
=![]() mol/L=0.45 mol/L;充入氧气排出
mol/L=0.45 mol/L;充入氧气排出![]() 体积的溶液,剩余溶液浓度不变,故剩余溶液的浓度为0.045 mol/L;
体积的溶液,剩余溶液浓度不变,故剩余溶液的浓度为0.045 mol/L;
(6)假设有氨气1 mol,氨气与NOx等物质的量恰好反应生成N2和水,则1 mol氨气失去电子1.5 mol,据氧化还原反应中电子守恒,1 mol NOx得电子1.5 mol,所以x=1.5。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法中不正确的是( )
A.向0.1molL-1CH3COOH溶液中加入少量水,溶液中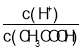 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 减小
减小
C.向盐酸中加入氨水至中性,溶液中![]() =1
=1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃和101 kPa时,甲烷、乙烷和乙烯组成的混合烃4 mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了9 mL,原混合烃中乙烯的体积分数为
A.12.5%B.25%C.50%D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是
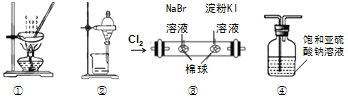
A.图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.图②所示装置,分离CCl4萃取I2水后的有机层
C.图③所示装置,证明氧化性:Cl2>Br2>I2
D.图④所示装置,除去SO2中混有的少量HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com