
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸60mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
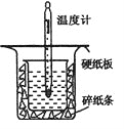
(1)从图中实验装置看,其中尚缺少的一种玻璃用品是_______,除此之外,装置中的一个明显错误是______。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于______。
(3)若改用60mL0.25mol·L-1H2SO4和60mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量____(填“相等”、“不相等”),若实验操作均正确,则所求中和热_____填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:______。(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:______。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
【答案】环形玻璃搅拌棒 小烧杯口未用硬纸板盖住(或大小烧杯口未齐平) 隔热,减少热量的损失 不相等 相等 C D 3.4 -56.8kJ/mol abc
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平;
(2)中和热测定实验成败的关键是减少热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)为了减少热量散失,使测量结果更加准确,应迅速一次性将氢氧化钠溶液倒入烧杯中;
(5)通过环形玻璃棒慢慢搅拌,可以使氢氧化钠溶液与硫酸混合均匀;
(6)①先计算出每次实验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
②根据Q=mc△T计算,先根据Q=mc△T计算反应放出的热量,然后根据△H=-![]() kJ/mol计算出反应热;
kJ/mol计算出反应热;
③a.实验装置保温、隔热效果必须好;
b.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;
c.若分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致散失过多的热量。
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.25mol/LH2SO4和50mL0.55mol/LNaOH溶液进行反应与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
(4)中和热的测定中,必须尽量减少热量散失,所以倒入氢氧化钠溶液时,必须一次并且迅速倒入烧杯中,故合理选项是C;
(5)A.温度计用于测定温度,不能使用温度计搅拌溶液,A错误;
B.揭开硬纸片用玻璃棒搅拌,会导致热量散失,影响测定结果,B错误;
C.轻轻地振荡烧杯,会导致溶液溅出,甚至导致热量散失,影响测定结果,C错误;
D.用套在温度计上的环形玻璃棒轻轻地搅动,可以使硫酸和氢氧化钠溶液混合均匀,又可以减少热量散失,D正确;
故合理选项是D;
(6)①四次测定温度差分别为3.4℃,5.1℃,3.3℃,3.5℃,其中第2次的温度差误差较大,应该舍弃,其它三次温度差的平均值为t=![]() ℃=3.4℃;
℃=3.4℃;
②50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-![]() =-56.8 kJ/mol;
=-56.8 kJ/mol;
③a.实验装置保温、隔热效果必须好,否则测定结果偏小,a正确;
b.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,由于温度计上会有氢氧化钠,氢氧化钠与硫酸反应放热,导致硫酸的起始温度偏高,温度差偏小,测定结果偏小,b正确;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,c正确;
故合理选项是abc。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列图示实验合理的是( )
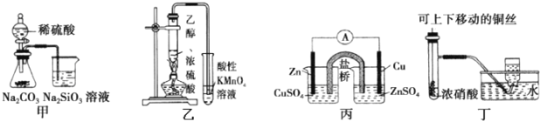
A.图甲证明非金属性强弱:S>C>Si
B.装置乙可用于检验有乙烯生成
C.图丙构成铜锌原电池,产生持续稳定的电流
D.图丁可制备并收集NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
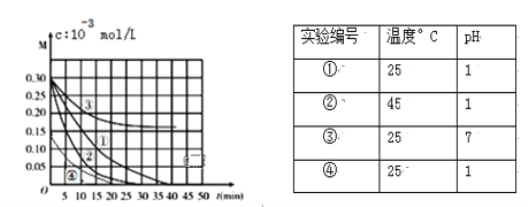
下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是原子序数依次增大的短周期元素,且
是原子序数依次增大的短周期元素,且![]() 原子序数之和是
原子序数之和是![]() 原子序数之和的
原子序数之和的![]() 。甲、乙、丙、丁是由这些元素组成的二元化合物,
。甲、乙、丙、丁是由这些元素组成的二元化合物,![]() 是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物
是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物![]() 是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 由四种元素形成的两种盐,水溶液中反应能生成![]()
B. ![]() 与
与![]() 形成的化合物中阴、阳离子个数比可为1:1
形成的化合物中阴、阳离子个数比可为1:1
C. 化合物![]() 、乙烯使溴水褪色的原理相同
、乙烯使溴水褪色的原理相同
D. ![]() 与
与![]() 形成的化合物中,成键原子均满足8电子结构
形成的化合物中,成键原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质间的转化关系,其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B为常见的能产生温室效应的气体;E是最简单的有机物,且标准状况下密度为0.714g·L-1。乙和丁为黑色固体,将它们混合后加热发现固体由黑变红。
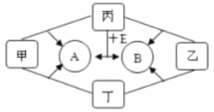
(1)写出化学式:乙___;丙___;
(2)丁的摩尔质量__;
(3)写出丙和E反应生成A和B的化学方程式___;
(4)有同学将乙和丁混合加热后收集到的标准状态下气体8.96L,测得该气体是氢气密度的16倍,若将气体通入足量澄清石灰水,得到白色沉淀物___g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: H+、Na+、MnO![]() 、SO
、SO![]()
B. 碱性溶液中:Na+、K+、SiO![]() 、NO
、NO![]()
C. 能溶解Al2O3的溶液中:Mg2+、Cu2+、HCO![]() 、Cl-
、Cl-
D. 含有Fe2+的溶液中:H+、Ca2+、NO![]() 、AlO
、AlO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴甲基-1-环己烯的一种合成路线如下,下列说法正确的是
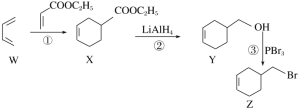
A.X、Y、Z都属于芳香族化合物
B.①②③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是与人类生活密切相关的一种重要元素。根据要求回答:
(1)写出N2的电子式_________;将空气中的氮气转化为含氮化合物的过程称为固氮,当今大规模人工固氮的主要方法是(用化学方程式表示)______________________________。
(2)某无色混合气体中可能含有NH3、O2、H2、NO、HCl等气体,将它通过浓H2SO4 后发现气体体积减少,将剩余气体与空气接触后呈红棕色,此混合气中一定不含有_________。
(3)实验室有多种制取氨气的方法,其中加热消石灰与氯化铵的混合固体就是方法之一。
①写出此反应的化学方程式:_____________________________________________。
②氨气可使湿润的红色石蕊试纸变蓝的原因(用相应的方程式说明)_______________。
③用乙装置(见图)吸收一段时间氨气后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,锥形瓶中不可能生成的物质是___(选填序号)。

a H2 b NO2 c HNO3 d NH4NO3
写出乙装置中氨催化氧化的化学方程式:__________________________。
(4)已知3Cl2+2NH3==N2 + 6HCl,若NH3过量则还有反应:NH3+ HCl== NH4Cl 。常温常压下,若在一密闭容器中将15mLCl2和40mL NH3充分混合反应后,剩余气体的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物只含C、H、O三种元素,取4.6g该有机化合物完全燃烧,测得只生成0.2molCO2和5.4g水,其质谱图和核磁共振氢谱如图所示,回答下列问题: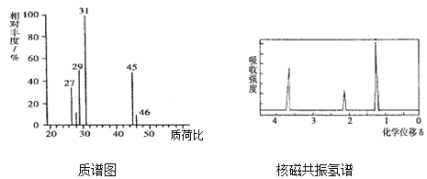
(1)该有机物的相对分子质量为:______________
(2)该有机物的分子式为:______________
(3)该有机物的结构简式为:______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com