
已知25℃、101kPa 下:① 2Na(s)+1/2O2(g)= Na2O(s) △H1 =-414KJ/mol
② 2Na(s)+O2(g)= Na2O2(s) △H2 =-511KJ/mol 则下列说法正确的是:
A.等质量的钠分别发生反应①和②,产物的阴阳离子个数比相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列有关物质性质的说法错误的是
A.热稳定性:HCl>HI B.原子半径:Na>Mg
C.酸性:H2SO3>H2SO4 D.还原性: S2->Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,共放出x kJ热量;已知每摩尔单质碳完全燃烧生成CO2放出热量为y kJ,则1mol C与O2反应生成CO的反应热△H为:(单位:kJ•mol﹣1)
A.-y ; B.-(10x﹣y); C.-(5x-0.5y); D.+(10x﹣y)
查看答案和解析>>
科目:高中化学 来源: 题型:
将3摩A和2.5摩B混合于2升密闭容器中,发生如下反应:3A十B xC+2D。过5分钟后反应达平衡,这时生成1摩D,C的平均反应速度是0.1摩/(升·分)。下列说法错误的是:
xC+2D。过5分钟后反应达平衡,这时生成1摩D,C的平均反应速度是0.1摩/(升·分)。下列说法错误的是:
A.A的平均反应速度为0.15摩/(升·分) B. x值为1
C.B的平衡浓度为0.5摩/升 D. B的转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可以反应:
反应Ⅰ: 2NH3(l) + H2O (l) + CO2 (g)  (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ: NH3(l) + H2O (l) + CO2 (g)  NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ: (NH4)2CO3(aq) + H2O (l) + CO2 (g)  2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
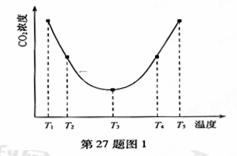 请回答下列问题:
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3= 。
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度
T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入
一定量的CO2(用氮气作为稀释剂),在t时刻,测得容器
中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,
保持其它初始实验条件不变,重复上述实验,经过相同
时间测得CO2气体浓度,得到趋势图(见图1)。
则△H3 0(填>、=或<)。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
700℃时,H2(g)+CO2(g)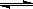 H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025
mol/(L·min),下列判断不正确的是
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.10 | 0.20 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.10 | 0.20 |
A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为aL,则a的取值范围是 。
(3)若剩余气体的体积为a L,则原CO和H2的混合气中V(CO)︰V(H2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO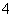 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com