
【题目】(1)在氧化还原反应中,氧化剂__电子,发生的反应是__反应;还原剂__电子,发生的反应是__反应。铁与氯气反应的方程式为2Fe+3Cl2![]() 2FeCl3,生成物中铁是__价,铁与盐酸的反应式为___,生成物中铁是__价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)___。
2FeCl3,生成物中铁是__价,铁与盐酸的反应式为___,生成物中铁是__价,这一事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)___。
(2)0.6mol的氧气与0.4mol臭氧O3质量之比为___,分子个数之比为___,氧原子个数之比为___。
(3)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是:___。
(4)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A.B两组,而且每组中均含两种阳离子和两种阴离子。
A组:___;B组:____。
【答案】得到 还原 失去 氧化 +3 Fe+2HCl=FeCl2+H2↑ +2 强 1:1 3:2 1:1 蒸馏 Cu2+ H+ NO3- Cl- Na+ K+ OH- CO32-
【解析】
(1)在氧化还原反应中,氧化剂得电子,化合价降低,发生还原反应;还原剂失电子,化合价升高,发生氧化反应。
(2)利用有关物质的量与质量、摩尔质量的关系进行计算。
(3)两液体混合物的沸点相差较大,可利用蒸馏法进行分离。
(4)利用离子共存,将离子分成两组。
(1)在氧化还原反应中,氧化剂得电子,发生的反应是还原反应;还原剂失去电子,发生的反应是氧化反应。铁与氯气反应的方程式为2Fe+3Cl2![]() 2FeCl3,生成物中铁是+3价,铁与盐酸的反应式为Fe+2HCl=FeCl2+H2↑,生成物中铁是+2价,这一事实证明,氯气的氧化性比盐酸的氧化性强。
2FeCl3,生成物中铁是+3价,铁与盐酸的反应式为Fe+2HCl=FeCl2+H2↑,生成物中铁是+2价,这一事实证明,氯气的氧化性比盐酸的氧化性强。
答案:得到;还原;失去;氧化;+3;Fe+2HCl=FeCl2+H2↑;+2;强。
(2)0.6mol的氧气与0.4mol臭氧O3质量之比为
![]() ,
,
分子个数之比为![]() ,
,
氧原子个数之比为![]() ;
;
答案:1:1;3:2;1:1。
(3)从表中数据可以看出,A、B的沸点相差较大,将A和B相互分离的常用方法是蒸馏;答案:蒸馏。
(4)我们从Cu2+切入,设其在A组,则与Cu2+不共存的离子CO32-、OH-在B组;与CO32-、OH-不共存的H+在A组。按每组中均含两种阳离子和两种阴离子,将余下的4种离子进行分配,从而得出。A组所含离子为Cu2+、H+、NO3-、Cl-,B组所含离子为Na+、K+、OH-、CO32-。
答案:Cu2+、H+、NO3-、Cl-;Na+、K+、OH- 、CO32-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1) 如图所示是分离混合物时常用的仪器,回答下列问题:
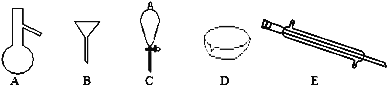
①写出仪器C、E的名称________________、________________。
②分离以下混合物应该主要选用上述什么仪器(填字母符号)
a.粗盐和泥沙:________ b.花生油和水___________。
(2)按照物质的树状分类和交叉分类,硫酸应属于___________。
①酸 ②能导电的纯净物 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦电解质
A.①②③④⑦ B.①③⑤⑥⑦ C.①②③⑤⑥⑦ D.②③⑤⑥⑦
(3)往Fe(OH)3胶体中逐滴加入过量的3mol/L硫酸产生的现象是_______________________。
(4)现在有下列10种物质:① H2O ②空气 ③Mg ④ NH3 ⑤ 稀H2SO4⑥ Ca(OH)2 ⑦CuSO4 .5 H2O ⑧碘酒⑨无水乙醇⑩NaHCO3其中,⑤在水溶液中的电离方程式为______,属于电解质的是__________ (填序号,下同);属于非电解质的是__________ ;属于既不是电解质也不是非电解质的是__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是七大基本物理量之一,计算并回答下列问题:
(1)标准状况下,33.6LH2S的物质的量为___mol,质量为___g,所含H原子的数目为____;
(2)16g的O2和O3混合气体中含有O原子数目为____;
(3)1mol/L的BaCl2溶液0.5L中含有Ba2+的物质的量浓度为__mol/L,含有Cl—的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和H2O。
(1)写出并配平该反应的方程式____;
(2)发生氧化反应的物质是___,反应中4mol的氧化剂能得到___mol电子;
(3)反应中产生了11.2L(标准状况)的气体时,被还原的物质的质量为___g;
(4)向NH4Cl溶液中滴加NaOH溶液并加热会放出气体,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 溶液中导电粒子的数目减少
C. 醋酸的电离程度增大,c(H+)也增大
D. 再加入10 mL pH=11的NaOH溶液后pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能说明2NO2(g)![]() N2O4(g)已达到平衡状态的是( )
N2O4(g)已达到平衡状态的是( )
A. 温度和压强一定时,混合气体的密度不再变化
B. 温度和体积一定时,容器内压强不再变化
C. 条件一定,混合气体的平均相对分子质量不再变化
D. 反应速率2v(NO2)逆=v(N2O4)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 常温下,0.1 mol·L一1的碳酸钠溶液中含有的阴离子数大于0.1NA
B. 标准状况下,33.6 mL氯气通人足量水中发生反应,转移电子数为1.5×10-3NA
C. 常温常压下,28 g由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA
D. 同温下,pH=1体积为1 L的硫酸溶液所含氢离子数与pH=13体积为1 L的氢氧化钠溶液所含氢氧根离子数均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如图,先获得不溶性草酸氧钛钡晶体BaTiO(C2O4)2·4H2O,煅烧后可获得钛酸钡粉体。下列说法不正确的是( )
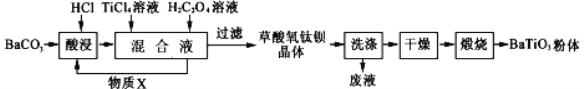
A. 酸浸时发生的反应的离子方程式为:BaCO3+2H+== CO2↑+Ba2++H2O
B. 加入H2C2O4溶液时,发生反应的化学方程式为:BaCl2+2H2C2O4+TiCl4+5H2O=BaTiO(C2O4)2·4H2O↓+6HCl
C. 可循环使用的物质X是CO2
D. 煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、CO2和H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3mol NH3中含有质子数与_________g H2O分子中所含质子数相等。
(2)100mL Al2(SO4)3溶液中c(SO42-)=0.9 mol/L,则n[Al2(SO4)3]=_____________。
(3)10mL 6 mol/L稀硫酸加水稀释到200mL,稀释后c(H+)=__________。
(4)已知某饱和NaCl溶液的体积为VmL。密度为ρg/cm3,质量分数为w。物质的量浓度为C mol/L,溶液中含NaCl的质量为m g.
①用m、V表示溶液物质的量浓度__________;
②用w、ρ表示溶液物质的量浓度__________;
③用w表示该温度下NaCl的溶解度________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com