
【题目】光纤通信是以光作为信息的载体,制造光导纤维的基本原料是( )
A.钢
B.铜
C.石英砂
D.铝
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 电解池将化学能转化为电能
B. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
C. 用惰性电极电解饱和NaCl溶液一段时间后,若 通入氯化氢气体,能使电解液恢复到原状态
D. 用惰性电极电解Na2SO4溶液,阴阳两极气体产物的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的联接并填空:其中a.b为惰性电极
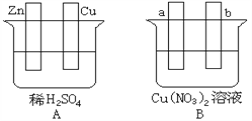
(1)在A图中,使铜片上冒H2气泡,加以必要联接,则联接后的装置叫______。锌片做_____ 极,铜电极上的反应式为_________________;溶液中向锌电极方向移动的离子是___________。
(2)在B图中,使a极析出铜,则b析出O2 ,加以必要的联接后,该装置叫____。装置中发生反应的化学方程式为__________________。经过一段时间后,停止反应并搅均溶液,溶液的酸性会____(增强、减弱、不变),若使溶液恢复至与电解前完全一致,可加入一定量的___________(填序号)。
A. Cu B. CuO C. Cu (OH)2 D. CuCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓与ⅤA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态Ga原子的核外电子排布式为__________,基态As原子核外有__________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__________和+3。砷的电负性比镓__________(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:__________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是_______________________________________。
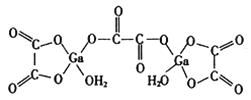
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为__________,草酸根中碳原子的杂化方式为__________。
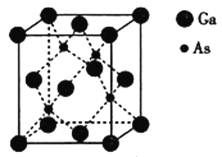
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,该晶体的类型为__________,晶体的密度为__________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. AZRn-有x个电子,则w克Rn-含有的中子数为![]()
B. 3517Cl和3717Cl互称同素异形体
C. D216O中,质量数之和是质子数之和的两倍
D. 在18g18O2中含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. Fe2O3溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B. Na2SO3与稀硝酸:SO32-+2H+=SO2↑+H2O
C. AlCl3溶液中加入足量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.原电池是一类重要的化学电源,请填写下列空白。
(1)将锌片和银片浸入稀H2SO4中组成原电池,两极间连接一个电流计,写出该电池的电极总化学反应方程式为__________。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称量,总质量为47g,则产生标况下的氢气_______升,导线上转移的电子为_____NA。
(3)若12.8g铜与一定量的浓HNO3混合反应,铜耗尽时共产生5.6L(标准状况)NO和NO2的混合气体,则所消耗的HNO3的物质的量为___,混合气体的平均相对分子质量为___。
Ⅱ.现有纯铁片、纯银片、纯铜片、稀硫酸、FeSO4溶液、Fe2(SO4)3溶液,大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:__________,正极__________。
(2)请在下面方框中画出原电池的装置图,要求:注明电解质溶液名称、正负极材料,并标出电子移动方向。
 __________。
__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
A.AlO2﹣
B.Cu2+
C.Al3+
D.Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com