
����Ŀ��(1)��֪����Fe(s)+![]() O2(g)=FeO(s) H1=-272.0kJ/mol
O2(g)=FeO(s) H1=-272.0kJ/mol
��2Al(s)+![]() O2(g)=Al2O3(s) H1=-1675.7kJ/mol
O2(g)=Al2O3(s) H1=-1675.7kJ/mol
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��__________________��ijͬѧ��Ϊ�����ȷ�Ӧ�����ڹ�ҵ����������ж���_____(������������������)��������________��
(2)��Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ��������µķ�Ӧ���̷ֱ�ΪA��B��ͼ��ʾ��
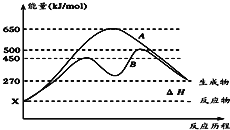
����ͼ�жϸ÷�Ӧ��_______(����������������)�ȷ�Ӧ��
������B���̱����˷�Ӧ���õ�����Ϊ________(����ĸ)��
A.�����¶� B.����Ӧ���Ũ�� C.�����¶� D.ʹ�ô���
(3)���ȷ��dz��õĽ�����������֮һ����֪��
4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
Mn(s)+O2(g)=MnO2(s)H=-521kJ/mol
Al��MnO2��Ӧұ������Mn���Ȼ�ѧ����ʽ��___________________��
(4)�й�����ֵ�������ʾ��2013�����ƽ����������Ϊ52����֮��γ���������Ҫ�ɷ�Ϊ�����������ŷŵķ���������β�����ﳾ�ȡ���CH4������������β���е����������Ⱦ��
��֪��CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
2NO2(g)=N2O4(g) H=-56.9kJ/mol
д��CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽ________________��
���𰸡� 2Al��s��+3FeO��s����Al2O3��s��+3Fe��s��H=-859.7kJ/mol ���� �÷�Ӧ��Ҫ��������Ҫ���Ĵ����������ɱ��ϸ� �� D 4A1(s)+3MnO2(s)=3Mn(s)+2Al2O3(s)H=-1789kJ/mol CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)H=898.1kJ/mol
����������1�����ݸ�˹���ɼ����H���÷�Ӧ��Ҫ�������ɱ����ߣ�
��2������ͼ��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ��
����ͼ��֪����Ӧ����B��A��ȣ��ı䷴Ӧ���̣�Ӧ��ʹ�ô�����
��3�����ݸ�˹���ɼ����H��
��4�����ݸ�˹���ɼ����H��
��1����֪����Fe(s)+1/2O2(g)=FeO(s) H1=-272.0kJ/mol
��2Al(s)+3/2O2(g)=Al2O3(s) H1=-1675.7kJ/mol
������ʽ��-�١�3��2Al��s��+3FeO��s����Al2O3��s��+3Fe��s����H=-1675.7kJmol-1-��3��-272.0kJmol-1��=-859.7 kJmol-1��
���ȷ�Ӧ��Ҫþȼ�����������Ľ϶��������ɷֹ��ߣ���˲������ڹ�ҵ������
��2������ͼ��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ��
����ͼ��֪����Ӧ����B��A��ȣ��ı䷴Ӧ���̣����ﵽ��ͬ��ƽ��״̬���ı������Ӧ��ʹ�ô��������ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ���ΪD��
��3����֪����4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
��Mn(s)+O2(g)=MnO2(s) H=-521kJ/mol
���ݸ�˹���ɿ�֪�٣��ڡ�3���õ�Al��MnO2��Ӧұ������Mn���Ȼ�ѧ����ʽ��4A1(s)+3MnO2(s)=3Mn(s)+2Al2O3(s)H=-1789kJ/mol��
��4����֪����CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
��2NO2(g)=N2O4(g) H=-56.9kJ/mol
���ݸ�˹���ɿ�֪�٣��ڼ��õ�CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽCH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)H=898.1kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ����������
B. �ӵ�ʳ�κ��е����(KIO3)
C. ����������Ԫ�ؾ���ά����
D. ����������Ԫ�ز����ǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧʽ�У���ȷ���ǣ�������
A.�����ȼ����Ϊ 890.3 kJmol��1 �� �����ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=��890.3 kJmol��1
B.500�桢30MPa �£��� 0.5mol N2�� 1.5molH2�����ܱ������г�ַ�Ӧ���� NH3��g�������� 19.3 kJ�����Ȼ�ѧ����ʽΪ��N2+3H2��g�� ![]() 2NH3��g����H=��38.6 kJmol��1
2NH3��g����H=��38.6 kJmol��1
C.ϡ����� ϡ����������Һ��ϣ����Ȼ�ѧ����ʽΪ��H+��aq��+OH����aq��=H2O��l����H=��57.3 kJmol��1
D.1molH2��ȫȼ�շ��� 142.9kJ��������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g��=2H2O��l����H=+285.8 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ĥ����ԭ���͵绯ѧԭ���Ʊ������������ɫ������N2O5��װ����ͼ��ʾ������˵������ȷ����

A. �缫a�͵缫c������������Ӧ
B. �缫d�ĵ缫��ӦʽΪ2H++2e-=H2��
C. c�缫�ϵĵ缫��ӦʽΪN2O4-2e-+H2O=N2O5+2H+
D. װ��A��ÿ����64gSO2��������װ��A��װ��B�о���2moH+ͨ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L���������г���1molA��1molB��������ӦA��g��+B��g��=C��g������һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ�������������¶�˵����ȷ���ǣ�������
t/s | 0 | 5 | 15 | 25 | 35 | |
n��A��/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.ǰ 5 s ��ƽ����Ӧ����v��A��=0.03 molL��1s��1
B.����Ӧ�����ȷ�Ӧ
C.�����¶Ȳ��䣬��ʼʱ�������г���2molC����ƽ��ʱ��C��ת���ʴ���80%
D.�����¶Ȳ��䣬��ʼʱ�������г���0.2molA��0.2molB��1molC����Ӧ�ﵽƽ��ǰv��������v���棩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Ԫ�ؿ��γ�XY3���ۻ������X��Y�����ĵ����Ų�������(����)
A. X��3s23p2��Y��3s23p5 B. X��2s22p3��Y��2s22p4
C. X��3s23p1��Y��2s22p5 D. X��2s22p3��Y��1s1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס������ص缫���϶���������̼��(��ͼ)����ش��������⣺

��1���������о�ʢ��CuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������ǣ��׳��е�_____�����ҳ��е�____����
�����ҳ��������ĵ缫��Ӧ��____________��
��2���������о�ʢ�ű���NaCl��Һ��
��д���ҳ����ܷ�Ӧ�����ӷ���ʽ��___________________��
����ʪ��ĵ���KI��ֽ�����ҳظ�����������ֽ��������һ��ʱ����ַ�����ɫ��ȥ��������Ϊ������Cl2�����ɵ�I2����������Ӧ��Cl2��I2�����ʵ���֮��Ϊ5:1�������������ᡣ�÷�Ӧ�Ļ�ѧ����ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ����˵����ȷ���� �� ��
A.�����dz�𤽺״������
B.�������۲�����������
C.���ð�Ĥ���Գ�ȥAgI�����е�KNO3
D.������ֽ���Թ��˳�ȥ�����ʽ����е�ʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊһ�����˲������汻���ӣ��С�������������˽������ռ������֮�ơ���ҵ�ϳ�������ʯ����Ҫ�ɷ�3BeO��Al2O3��6SiO2���������������ʣ�ұ���룬һ�ּĹ����������£�
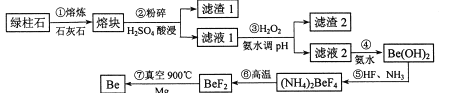
��Ԫ�����ڱ��ĶԽ��߹���Be��Al�������ƣ����ֽ��������ӵ������������ʱ��pH������ش��������⣺

(1)������н��ۿ�����Ŀ����_____________������1����Ҫ�ɷ���________��
(2)����ۼ���H2O2ʱ������Ӧ�����ӷ���ʽΪ__________������Һ1�еõ������ĺ���pHΪ__________������ţ���
A 3.3-3.7 8 3.7��5.0 C 5.0��5.2 D.5.2��6.5
(3)����ܲ���ʹ��NaOH��Һ������Be2+��ԭ����_____________������Һ�еõ�(NH4)2BeF4��ʵ�������_______�����ˡ�ϴ�ӡ����
(4)����ķ�Ӧ������_______���������Ҫ���������Ļ�������ԭ����_____________��
(5)������ʯ��Be0�ĺ���Ϊa%��������������Be�IJ���Ϊb%����1t������ʯ������������������2%�Ķ�ͭ�Ͻ�_______t��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com