
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
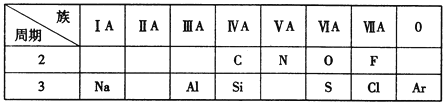
(1)化学性质最不活泼的元素是____(填元素名称);
(2)氮原子的一种氢化物常用作燃料电池的燃料,其电子式为________;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是_________(填化学式);
(4)碳原子的氢化物和氯气在光照条件下发生第一步反应的化学方程式是_____________;
(5)第3周期中气态氢化物最稳定的是________;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是___________(写出一种).
(7)Na、Al最高价氧化物的水化物之间反应的产物通入少量二氧化碳,发生反应的离子方程式是_________________________________.
(8)结构式为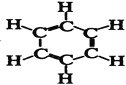 的有机物分子式是______,其中碳元素与氢元素的质量比m(C)∶m(H)=________(相对原子质量:H—1 C—12)。
的有机物分子式是______,其中碳元素与氢元素的质量比m(C)∶m(H)=________(相对原子质量:H—1 C—12)。
【答案】氩 ![]() HClO4 CH4+Cl2
HClO4 CH4+Cl2 ![]() CH3Cl+HCl HCl 集成电路、半导体等 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- C6H6 12:1
CH3Cl+HCl HCl 集成电路、半导体等 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- C6H6 12:1
【解析】
(1)稀有气体单质的化学性质最不活泼;
(2)氮原子的一种氢化物常用作燃料电池的燃料,该燃料为肼,据此分析书写肼的电子式;
(3)非金属性越强,最高价氧化物对应水化物酸性越强;
(4)碳原子的氢化物为甲烷,甲烷与氯气发生取代反应生成一氯甲烷和HCl;
(5)非金属性越强,气态氢化物越稳定;
(6)硅是良好的半导体材料;
(7)Na、Al最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠,在偏铝酸钠溶液中通入少量二氧化碳生成氢氧化铝沉淀和碳酸钠,据此书写反应的离子方程式;
(8)根据结构式,该有机物中含有6个C原子和6个H原子,据此分析解答。
(1)稀有气体单质的化学性质最不活泼,所给10种元素中只有Ar为稀有气体,故答案为:氩;
(2)氮原子的一种氢化物常用作燃料电池的燃料,该燃料为肼,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)非金属性越强,最高价氧化物对应水化物酸性越强,第3周期元素中,Cl元素非金属性最强,故HClO4的酸性最强,故答案为:HClO4;
(4)碳原子的氢化物为甲烷,甲烷与氯气在光照的条件下发生取代反应,第一步是1个氯原子替换出1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,反应方程式为CH4+Cl2 ![]() CH3Cl+HCl,故答案为:CH4+Cl2
CH3Cl+HCl,故答案为:CH4+Cl2 ![]() CH3Cl+HCl;
CH3Cl+HCl;
(5)非金属性越强,气态氢化物越稳定,第3周期元素中,Cl元素非金属性最强,气态氢化物最稳定的是HCl,故答案为:HCl;
(6)晶体硅的主要用途是:集成电路、半导体、太阳能电池板等,故答案为:集成电路、半导体等;
(7)Na、Al最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应的化学方程式为Al(OH)3 + NaOH=NaAlO2 + 2H2O,在偏铝酸钠溶液中通入少量二氧化碳,反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(8)根据结构式,该有机物中含有6个C原子和6个H原子,分子式为C6H6,其中m(C)∶m(H)=12×6∶1×6=12∶1;故答案为:C6H6;12∶1。


科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃; ③____________________________。
(3) 若pH过高,则对产品的影响是_________________________。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
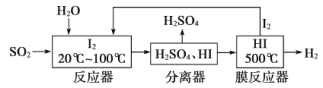
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溴乙烷的说法正确的是( )
A.溴乙烷的电子式![]()
B.用溴乙烷制取乙二醇经过以下几步:消去![]() 加成
加成![]() 水解
水解
C.溴乙烷与KOH醇溶液反应:CH3CH2Br+H2O![]() C2H5OH+KBr
C2H5OH+KBr
D.向溴乙烷中滴入![]() 溶液检验其中的溴元素:
溶液检验其中的溴元素:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
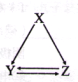
选项 | X | Y | Z |
A | AlCl3 | Al(OH)3 | NaAlO2 |
B | C | CO | CO2 |
C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
D | S | SO2 | SO3 |
A.AB.BC..CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是 ( )
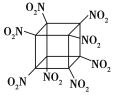
A. 分子中C、N间形成非极性键B. 1 mol该分子中含8 mol二氧化氮
C. 该物质既有氧化性又有还原性D. 该物质爆炸产物是NO2、CO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.已知X在一定条件下转化为Y,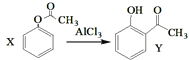 ,X与Y互为同系物,可用
,X与Y互为同系物,可用![]() 溶液鉴别
溶液鉴别
B.![]() 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应
能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应
C.![]() 甲基
甲基![]() 乙基戊烷的一氯取代产物有5种
乙基戊烷的一氯取代产物有5种
D.相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com