
【题目】元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 在元素周期表2、3、4周期中,元素
在元素周期表2、3、4周期中,元素![]() 、
、![]() 、
、![]() 、
、![]() 与元素
与元素![]() 相邻,已知:
相邻,已知:![]() 元素为磷元素;
元素为磷元素;![]() 的氯化物分子呈正四面体结构:
的氯化物分子呈正四面体结构:![]() 与
与![]() 可以形成一种高温结构陶瓷;
可以形成一种高温结构陶瓷;![]() 的最高化合价氧化物的水化物是强酸。下列选项错误的是( )
的最高化合价氧化物的水化物是强酸。下列选项错误的是( )
A.![]() 的氧化物的晶体类型是共价晶体
的氧化物的晶体类型是共价晶体
B.![]() 的单质在空气中广泛存在
的单质在空气中广泛存在
C.![]() 和
和![]() 形成的化合物中,
形成的化合物中,![]() 可以呈现的最高化合价是
可以呈现的最高化合价是![]() 价
价
D.![]() 、
、![]() 、
、![]() 的氢化物中,沸点最低的是
的氢化物中,沸点最低的是![]() 的氢化物
的氢化物
【答案】D
【解析】
由“元素Q、R、W、Y、X在元素周期表2、3、4周期中,元素Q、R、W、Y与元素X相邻,且X元素为磷元素”可知Q、R、W、Y分别为N、Si、S、As中的一种。因为W的氯化物为正四面体型,则应为SiCl4,则W为Si,又W与Q形成高温陶瓷,高温陶瓷可联想到Si3N4 ,则Q为N,Y的最高价氧化的水化物为强酸,且与P相邻,则Y只能是S,R为As,所以Q、R、W、Y、X分别为N、As、Si、S、P。
A.![]() 的氧化物为SiO2,其晶体类型为原子晶体,又称共价晶体,A正确;
的氧化物为SiO2,其晶体类型为原子晶体,又称共价晶体,A正确;
B.![]() 的单质为N2,在空气中广泛存在,在空气中的体积分数约为78%,B正确;
的单质为N2,在空气中广泛存在,在空气中的体积分数约为78%,B正确;
C.R最外层电子数为5,则最高化合价为+5,在![]() 和
和![]() 形成的化合物中,R的最高价化合物应为As2S5,C正确;
形成的化合物中,R的最高价化合物应为As2S5,C正确;
D.![]() 、
、![]() 、
、![]() 的氢化物分别为NH3、AsH3、PH3,因三者中只有NH3分子间存在氢键,所以沸点最高,因相对分子质量AsH3>PH3,则AsH3分子间的作用力大于PH3,故沸点AsH3>PH3,氢化物沸点顺序为NH3>AsH3>PH3,所以沸点最低的是X的氢化物,D错误;
的氢化物分别为NH3、AsH3、PH3,因三者中只有NH3分子间存在氢键,所以沸点最高,因相对分子质量AsH3>PH3,则AsH3分子间的作用力大于PH3,故沸点AsH3>PH3,氢化物沸点顺序为NH3>AsH3>PH3,所以沸点最低的是X的氢化物,D错误;
答案选D。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
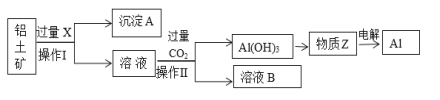
(1)操作Ⅱ的名称___________,用到的玻璃仪器有_______________。
(2)X是___________,操作Ⅱ通入过量CO2的离子方程式:____________。
(3)沉淀A的主要成分是________,溶液B中的成分为:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1L未知成分的混合溶液,其中除了含有0.2mol/L的Na+外,还可能含有下列离子中的一种或几种:
![]()
现进行如下实验操作(每次实验所加试剂均过量):
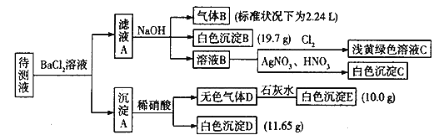
已知:①![]() ,②
,②![]() ,Cl2在常温下为黄绿色气体,可溶于水,其水溶液为浅黄绿色;Br2在常温下是深红棕色液体,微溶于水,其水溶液为黄色。
,Cl2在常温下为黄绿色气体,可溶于水,其水溶液为浅黄绿色;Br2在常温下是深红棕色液体,微溶于水,其水溶液为黄色。
(1)由气体B可确定待测液中含有的离子是____________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有_____离子,据此可以排除的离子是_____。
(3)由白色沉淀B可确定待测液中含有的离子是____,写出产生沉淀B的离子方程式_______。
(4)某同学读图后,认为待测液中一定不含Br—,他的判断依据是______。
(5)综合分析,待测液中![]() 的物质的量浓度的取值范围为________。
的物质的量浓度的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
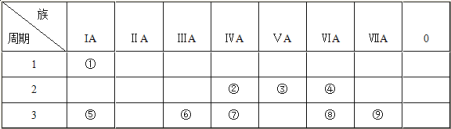
(1)④、⑤、⑧三种元素中,离子半径由大到小的顺序为____(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______ (填化学式)。⑧和⑨元素的气态氢化物稳定性顺序为__________。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为____。
(4)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式________。
(5)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最高价氧化物反应的化学方程式为_________。
(6)能说明⑧的非金属性比⑨的非金属性______(填“强”或“弱”)的事实是__________(用离子方程式说明)。
(7)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
A. 反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B. 根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C. 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
D. 可以推理得到Cl2+FeBr2 =FeCl2+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:①![]() 位于周期表中第四周期
位于周期表中第四周期![]() 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:②![]() 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③![]() 原子核外
原子核外![]() 层电子数为奇数;④
层电子数为奇数;④![]() 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤![]() 原子
原子![]() 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种![]() 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
(2)在1个由![]() 与
与![]() 形成的
形成的![]() 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的![]() 原子数目为____________个。
原子数目为____________个。
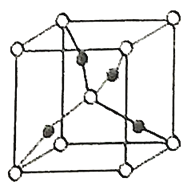
(3)在[F(NH3)4]2+离子中,![]() 的空轨道接受
的空轨道接受![]() 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下![]() 、
、![]() 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质![]() 是__________(写名称),
是__________(写名称),![]() 物质分子中
物质分子中![]() 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________,![]() 分子中
分子中![]() 键的数目为__________
键的数目为__________![]() 。
。
(5)![]() 、
、![]() 、
、![]() 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)![]() 泄漏会导致人体中毒,用于检测
泄漏会导致人体中毒,用于检测![]() 的传感器的工作原理如图所示:
的传感器的工作原理如图所示:

①写出电极Ⅰ上发生的反应式:__________
②工作一段时间后溶液中![]() 的浓度__________(填“变大”、“变小”或“不变”)
的浓度__________(填“变大”、“变小”或“不变”)
(2)用![]() 氧化
氧化![]() 制取
制取![]() ,可提高效益,减少污染。反应为:
,可提高效益,减少污染。反应为:![]() ,通过控制条件,分两步循环进行,可使
,通过控制条件,分两步循环进行,可使![]() 转化率接近100%,其原理如图所示:
转化率接近100%,其原理如图所示:

过程Ⅰ的反应为:![]()
过程Ⅱ反应的热化学方程式(![]() 用含有
用含有![]() 和
和![]() 的代数式表示)__________。
的代数式表示)__________。
(3)在温度![]() ,容积为
,容积为![]() 的绝热容器中,充入
的绝热容器中,充入![]() ,发生反应:
,发生反应:![]() ,容器中
,容器中![]() 的相关量随时间变化如图所示。
的相关量随时间变化如图所示。

①反应到![]() 时,
时,![]() 的转化率是__________。
的转化率是__________。
②根据图示,以下各点表示反应达到平衡状态的是________。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
③![]() 内容器中
内容器中![]() 的反应速率增大,而
的反应速率增大,而![]() 后容器中
后容器中![]() 的反应速率减小了,原因是_______。
的反应速率减小了,原因是_______。
④此容器中反应达平衡时,温度若为![]() ,此温度下的平衡常数
,此温度下的平衡常数![]() =__________。
=__________。
(4)工业上可用![]() 溶液吸收法处理
溶液吸收法处理![]() ,25℃时用
,25℃时用![]() 的
的![]() 溶液吸收
溶液吸收![]() ,当溶液
,当溶液![]() 时,溶液中各离子浓度的大小关系为:
时,溶液中各离子浓度的大小关系为:![]() 。(已知25℃时:
。(已知25℃时:![]() 的电离常数
的电离常数![]() ,
,![]() )请结合所学理论通过计算说明
)请结合所学理论通过计算说明![]() 的原因__________。
的原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用原电池原理可以除去酸性废水中的三氯乙烯和![]() ,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是
,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是
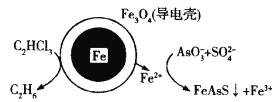
A.纳米铁发生还原反应
B.正极电极反应式:C2HCl3+5H++8e-=C2H6+3Cl-
C.导电壳上电极反应式:![]() +
+![]() +14Fe2++14H+=FeAsS↓+13Fe3++7H2O
+14Fe2++14H+=FeAsS↓+13Fe3++7H2O
D.当电路中有0.4 mol电子转移时,就会有11.2 L乙烷生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶态分散系是一种粒子直径介于1~100nm的一种分散系,如图是Fe(OH)3胶体的结构示意图,下列说法不正确的是( )
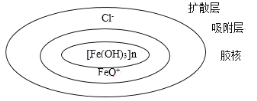
A.据图可以判断,发生了Fe(OH)3(胶体)+HCl![]() FeOCl+2H2O的反应
FeOCl+2H2O的反应
B.当用其做电泳实验时,阴极管的液面低于阳极管
C.电泳实验出现的现象的原因是:扩散层与吸附层分离,带正电的胶核向阴极移动
D.若对其加热一段时间,会发生胶体的聚沉作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com