
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态,其电路工作原理如图所示。下列说法中正确的是( )
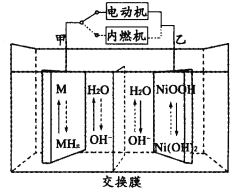
A.放电时乙为正极,充电时乙为阴极
B.汽车上坡时发生图中虚线所示的过程
C.放电时负极的电极反应式为:MHn-ne-=M+nH+
D.电池充电时,OH-由甲侧向乙侧移动
【答案】D
【解析】
根据汽车上坡或加速时,发生图中实线所示的过程,电动机提供推动力可知:电解质为碱性物质,甲为负极发生氧化反应,电极反应式为MHn-ne-+nOH-=M+nH2O,乙为正极;电池充电时是电解池,甲电极是阴极,乙是阳极。
A.根据汽车上坡或加速时,电动机提供推动力可知:甲为负极、乙为正极,电池充电时是电解池,甲电极是阴极,乙是阳极,故A错误;
B.汽车下坡时发动机在工作,属于充电过程,发生图中虚线所示的过程,故B错误;
C.放电时负极发生氧化反应,电极反应式为MHn-ne-+nOH-=M+nH2O,故C错误;
D.电池充电时是电解池,电解池中的甲电极是阴极,乙是阳极,所以OH-由甲侧向乙侧移动,故D正确;
故选D.


科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液![]() A和食盐的饱和溶液
A和食盐的饱和溶液![]() 悬浊液
悬浊液![]() 晶体
晶体![]() 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S存在于多种燃气中,脱除燃气中H2S的方法很多。
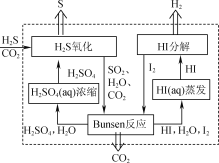
(1) 2019年3月《science direct》介绍的化学链技术脱除H2S的原理如图所示。
①“H2S氧化”反应中氧化剂与还原剂的物质的量之比为________。
②“HI分解”时,每1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,写出该反应的热化学方程式:________。
③“Bunsen反应”的离子方程式为________。
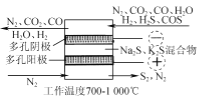
(2) 电化学干法氧化法脱除H2S的原理如图所示。阳极发生的电极反应为________;阴极上COS发生的电极反应为________。
(3) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
(Ⅰ) H2S(g)![]() H2S(aq)
H2S(aq)
(Ⅱ) H2S(aq) ![]() H++HS-
H++HS-
(Ⅲ) HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。

①吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是________。
②图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,这是由于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质.
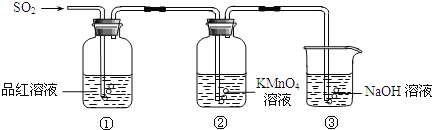
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是 .
(2)当观察到②中溶液颜色变浅时,①中的现象是 .
(3)装置③的作用是 .
(4)①、②中的现象说明二氧化硫具有的性质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校同学设计下列实验,探究CaS脱除烟气中的SO2并回收S。实验步骤如下:
步骤1.称取一定量的CaS放入三口烧瓶中并加入甲醇作溶剂(如下图所示)。
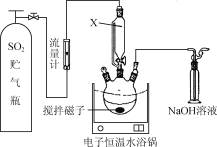
步骤2.向CaS的甲醇悬浊液中缓缓通入一定量的SO2。
步骤3.过滤,得滤液和滤渣。
步骤4.从滤液中回收甲醇(沸点为64.7 ℃),所得残渣与步骤3的滤渣合并。
步骤5.用CS2从滤渣中萃取回收单质S。
(1) 图中用仪器X代替普通分液漏斗的突出优点是________________。
(2) 三口烧瓶中生成硫和亚硫酸钙的化学方程式为________________,三口烧瓶中最后残留固体中含一定量的CaSO4,其原因是________________。
(3) 步骤4“回收甲醇”需进行的操作方法是________________。
(4) 步骤5为使滤渣中S尽可能被萃取,可采取的操作方案是________________。
(5) 请设计从上述回收的S和得到的含Na2SO3吸收液制备Na2S2O3·5H2O的实验方案:
称取稍过量硫粉放入烧杯中,__________________________________________,用滤纸吸干。
已知:① 在液体沸腾状态下,可发生反应Na2SO3+S+5H2O![]() Na2S2O3·5H2O。
Na2S2O3·5H2O。
②硫不溶于Na2SO3溶液,微溶于乙醇。
③为获得纯净产品,需要进行脱色处理。
④须使用的试剂:S、Na2SO3吸收液、乙醇、活性炭。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化镁是迄今发现的临界温度最高的简单的金属化合物超导材料。回答下列问题:
(1)基态硼的电子排布图为__,基态镁原子的电子运动状态有__种。
(2)BF3的键角(填“大于”、“小于”或“等于”)__NF3的键角,理由是__。
(3)碱土金属的碳酸盐热分解反应模式为:MCO3(s)=MO(s)+CO2(g)。从结构的角度解释:MgCO3的热分解温度小于CaCO3的热分解温度的原因是__。
(4)已知硼化镁属六方晶系(如图1所示)a=b≠c,α=β=90°,γ=120°。又知硼化镁是一种插层型离子化合物,镁层和硼层交替排列;镁原子层呈三角形结构,硼原子层具有规则的六角蜂房结构,与石墨相似。硼化镁晶体沿z轴方向的投影如图2所示,黑球代表硼原子,白球代表镁原子。硼化镁的化学式为__;B的配位数是__。

(5)已知硼化镁的晶格常数为:a=b=0.3086nm,c=0.3524nm,则硼化镁晶体的密度表达式为__g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
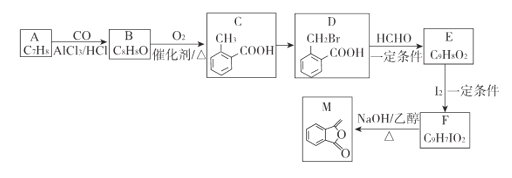
【题目】化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制备M的一种合成路线如下:
已知:R1CH2Br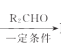 R1CH=CHR2
R1CH=CHR2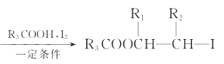
回答下列问题:
(1)A的结构简式为_______;B中官能团的名称为_______;C的化学名称为_________。
(2)由C生成D所需的试剂和条件为_______,该反应类型为____________.
(3)由F生成M的化学方程式为__________________________________。
(4)Q为M的同分异构体,满足下列条件的Q的结构有________种(不含立体异构),任写出其中一.种核磁共振氢谱中有4组吸收峰的结构简式_________________。
①除苯环外无其他环状结构
②能发生水解反应和银镜反应
(5)参照上述合成路线和信息,以乙烯和乙醛为原料(无机试剂任选),设计制备聚2-丁烯的合成路线_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com