
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A.硫酸、CuSO4.5H2O、苛性钾 B.硫酸、空气、纯碱
C.氧化铁、胆矾、熟石灰 D.硝酸、食盐水、烧碱
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(I)在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色无味气体。已知:题中所涉及物质皆为中学化学中常见物质。回答下列问题:
(1)甲的化学式为 。
(2)写出乙在医疗上的一个用途 。
(3)在乙溶液中滴加丙溶液生成丁溶液的离子方程式为 。
(II)固体化合物X由四种常见的短周期元素组成,可用作牙膏中的添加剂。现取39.3g化合物X进行如下实验:

实验结束后得到15.3g固体2和6.0g固体3,且固体1、固体2、固体3都可用作耐高温材料。回答下列问题:
(1)NaOH的电子式为 ,沉淀2的化学式为 。
(2)固体X的化学式为 。
(3)溶液1中加入足量NaOH溶液反应的离子方程式为 。
(4)在高温下,固体3中某元素的单质可以与固体1发生置换反应,请写出此反应的化学方程式 。
(5)设计一个实验方案比较固体2和固体3中两种不同元素对应单质的活泼性强弱 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大。A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2-与Ar原子具有相同的电子层结构,w的合金用量最大、用途最广。
回答下列问题:
(1)D在元素周期表中的位置是______________________。
(2)A分别形成与C、E形成的最简单化合物中沸点较高的是___________________(填化学式),原因是________________________。
(3)A、C、D三种元素形成的物质中含有的化学键类型是________________________。
(4)灼热的炭能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为____________。
(5)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁电极的说法中,正确的是
A. 钢铁的吸氧腐蚀中铁是正极 B. 在铁片上镀铜时铁片作阳极
C. 电解饱和食盐水时可用铁作阴极 D. 镀锌铁板发生电化学腐蚀时铁是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化物按其溶解性可以分三类:①易溶于水的有K2S,Na2S,(NH4)2S等;②易溶于非氧化性强酸,不溶于水的有FeS,ZnS等;③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS,Ag2S,CuS,Cu2S等。其中,Ag2S,CuS,Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水。
(1)推测硫化氢通入硫酸铜溶液中能否发生反应?若能,写出反应的离子方程式;若不能,写出原因 。
(2)在氢硫酸溶液中改变下列条件,能使溶液中c(OH-)、c(S2-)都增大的是 。
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(3)已知在常温下,FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c(S2-)之间存在如下关系:c2(H+)·c(S2-)=1.0×10-22。在该温度下,将适量FeS投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)达到1 mol·L-1,应调节溶液的pH为____________(已知lg2=0.3)。
(4)将Hg加入到一定浓度的H2S溶液中,有氢气产生,原因为 。
(已知Hg在溶液中,存在平衡:Hg-2e—![]() Hg2+)
Hg2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年以来我国北方的“雾霾”污染日益严重。中科院“大气灰霾追因与控制”项目针对北京强霾过程进行分析,强霾过程中,出现了大量有毒有害的含氮有机颗粒物。燃煤和机动年尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②OCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
③H2O(g)=H2O(1)△H=-44.0kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________________________。
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如下图所示。

①写出该反应的化学方程式:________________________________。
②10min内该反应的速率v(N2)=___________;该反应达平衡时CO的转化率为___________;T℃时该化学反应的平衡常数K=___________。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是________。

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)以燃料电池为代表的新能源的推广“使用能大大降低污染物的排放。如图是一种甲醚燃料电池结构,请写出该电池负极的电极反应式:________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 物质不是电解质就是非电解质
B. 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物
C. 能导电的物质不一定是电解质,电解质也不—定能导电
D. 液氨溶于水能导电,所用是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是
A. 氟利昂-12的结构式为 ,该分子是平面型分子
,该分子是平面型分子
B. 苯与液溴混合后撤入铁粉发生了加成反应
C. 分子式为C4H9Cl的同分异构体共有4种
D. 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0. molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是( )
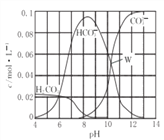
A. W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B. pH=14的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
D. pH=11的溶液中:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com