
【题目】下列各组离子一定能大量共存的是( )
A. 在无色溶液中:Na+ Fe3+ Cl— SO42-
B. 在含大量Fe3+ 的溶液中:NH4+ K+ NO3- OH-
C. 在强碱溶液中:Na+ K+ NO3- CO32—
D. 滴加紫色石蕊试剂显红的溶液中:K+ Fe2+ Cl— CO32—
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示。
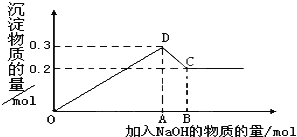
(1)写出下列线段内发生反应的方程式:
OD段__________________________________。
CD段__________________________________。
(2)图中C点表示加入________mol NaOH时。
(3)原溶液中来自MgCl2、AlCl3 的氯离子物质的量浓度之比为_____________。
(4)图中线段OB:OA=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A. K+、Na+、NO3-、MnO4- B. Mg2+、Na+、Cl-、SO42-
C. K+、Na+、Cl-、Cu2+ D. Na+、Ba2+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和 . 泡沫塑料的作用是 .
(2)若NaOH溶液用相同浓度和体积的下列溶液代替,则对中和热数值测定结果将如何影响(填“偏大”、“偏小”、“无影响”):KOH溶液;氨水(NH3H2O) .
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由题干及图形可知,V1:V2=时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)下列各组物质: A.金刚石与石墨;B.淀粉与纤维素;C.氕与氘;D.甲烷与戊烷;E.葡萄糖与果糖
F. 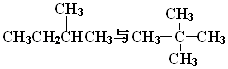 G.
G. 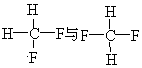
其中互为同位素的是(填编号,下同);互为同系物的是;互为同分异构体的是;是同一种物质的是 .
(2)化合物A的结构简式为: 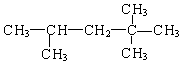 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式 .
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式 .
(3)篮烷分子的键线式如图所示,试回答: 
①写出篮烷分子的化学式;
②篮烷分子的一氯取代物的种数为种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:Ksp(AgCl)=1.8×10-10 , Ksp(AgI)=1.5×10-16 , Ksp(Ag2CrO4)=2.0×10-12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl >AgI> Ag2CrO4
B.AgCl> Ag2CrO4 >AgI
C.Ag2CrO4>AgCl >AgI
D.Ag2CrO4>AgI >AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测.某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+ , 其次是Fe3+ , Fe2+ , Al3+ , Ca2+ , Mg2+) 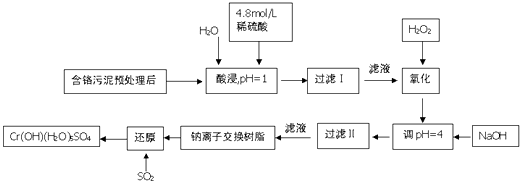
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | ﹣ |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是(至少一条)
(2)调pH=4.0是为了除去(填Fe3+ , Al3+ , Ca2+ , Mg2+)
(3)钠离子交换树脂的原理为Mn++n NaR→MRn+nNa+ , 被交换的杂质离子是(填Fe3+ , Al3+ , Ca2+ , Mg2+)
(4)试配平下列氧化还原反应方程式:Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是向MgCl2、AlCl3混合溶液中,开始滴加7 mL试剂A,之后改滴加试剂B,所得沉淀物质的量y (mol) 与试剂体积V(mL)间的关系如图所示。(试剂A、B分别是NaOH 溶液盐酸中的一种)
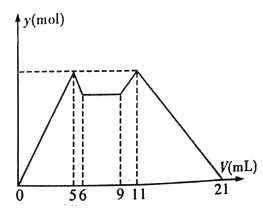
以下结论不正确的是
A. A是NaOH 溶液,B是盐酸
B. 原混合液中,c(Al3+) :c(Mg2+) :c(Cl-)=1:1:5
C. c(NaOH) :c(HCl)=1:2
D. 从6 到9 的过程中,发生的反应的离子反应方程式是H+ +OH-=H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com