
����Ŀ����NaOH��Һ���������е�SO2�������õ�Na2SO3��Һ���е�⣬��ѭ������NaOH��ͬʱ�õ�H2SO4����ԭ����ͼ��ʾ(�缫����Ϊʯī)
ͼ1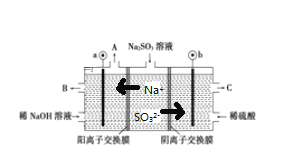 ͼ2
ͼ2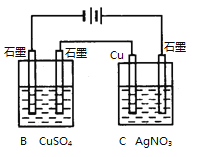
(1)ͼ1��a��Ҫ���ӵ�Դ��__________(����������������)����SO32-�ŵ�ĵ缫��Ӧ__________
(2)��ͼ2��ʾ��װ���У���ͨ��ֱ����5 minʱ��ͭ�缫��������2.16g���Իش�
����ҺpH�仯��B__________��C__________(��������������С������������)��
��ͨ��5 minʱ��B�й��ռ�224mL����(��״��)����Һ���Ϊ200mL����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ__________(����ǰ����Һ����ޱ仯)��
���𰸡����� SO32--2e-+H2O=SO42-+2H+ ��С ���� 0.025 mol��L-1
��������
(1)���ݵ������Һ���������ӵ��ƶ������жϵ缫������������������aΪ������bΪ������![]() ������ʧȥ���ӱ��
������ʧȥ���ӱ��![]() �����ܰ������������ӷŵ���������������C��������������H2SO4���������ŵ�����Ϊ�����������������ݴ˷������
�����ܰ������������ӷŵ���������������C��������������H2SO4���������ŵ�����Ϊ�����������������ݴ˷������
(2)��ͼ������Ϣ��֪��B��C����װ�ô�����ͬһ��·�С�����ͭ�缫��������2.16 g�������ж�ͭ�缫Ϊ���������Դ��X�缫Ϊ������Y�缫Ϊ���������ԣ�B�ǵ��ء�C�ǵ��װ�ã��ݴ˷���������⡣
(1)������������֪��a�ӵ�Դ������![]() ����������Ӧ���ŵ�ĵ缫��ӦʽΪ��
����������Ӧ���ŵ�ĵ缫��ӦʽΪ��![]() ���ʴ�Ϊ��������
���ʴ�Ϊ��������![]() ��
��
(2)�ٸ�������������֪��B�е������ͭ��Һ�������ᣬ��Һ��������Ũ������pH��С��C�ǵ��װ�ã�����������ӦΪAg++e-�TAg��������ӦΪAg-e-�TAg+����ҺŨ�Ȳ��䣬��pH���䣬�ʴ�Ϊ����С�����䣻
��ͨ��5 min��·��ͨ���ĵ���Ϊn(e-)=n(Ag)=![]() ��B���������ռ���O2��n(O2)=
��B���������ռ���O2��n(O2)=![]() ����ΪB�й��ռ�����״����224 mL���壨0.01mol��������B������һ������������0.005mol���ɴ˸��ݵ���ת���غ㣬����ȷ��B��һ������ͭ0.005mol��������Һ���Ϊ200 mL�����Լ����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ
����ΪB�й��ռ�����״����224 mL���壨0.01mol��������B������һ������������0.005mol���ɴ˸��ݵ���ת���غ㣬����ȷ��B��һ������ͭ0.005mol��������Һ���Ϊ200 mL�����Լ����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ![]() 0.025 mol��L��1���ʴ�Ϊ��0.025 mol��L��1��
0.025 mol��L��1���ʴ�Ϊ��0.025 mol��L��1��


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
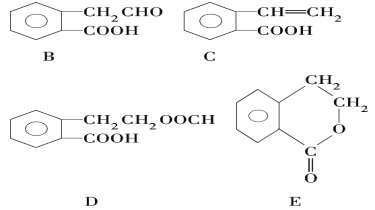
����Ŀ���л���A�Ľṹ��ʽΪ![]() ������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E�������ʡ�
������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E�������ʡ�
��ش��������⣺
��1����A��E���������У���Ϊͬ���칹�����____________ (�����)��
��2��C���γɸ߾���ø߾���Ľṹ��ʽΪ _______________________��
��3��ָ����Ӧ�����ͣ�A��C��_________��E�к��еĹ����ŵ����ƣ�_______
��4��д����A����B�Ļ�ѧ����ʽ_______________________��
��5����֪HCHO����������ԭ�Ӷ���ͬһƽ���ڣ������������������е�ԭ���п��ܶ���ͬһƽ���������__________________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����߸պ���ǰ����������
A.51 g����������ԭ������67.2 Lһ����̼����ԭ����
B.1molCO2��Ħ��������2 molCO2��Ħ������
C.50 mL 2 mol��L��1�Ȼ�����Һ��c(Cl��)��50 mL 2 mol��L��1�Ȼ�þ��Һ��c(Cl��)
D.1molNa2O2�������������������ӱ�ֵ��1molNa2O�������������������ӱ�ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��R��ԭ���������������ǰ����������Ԫ�أ�X���γɶ��ֵ��ʣ����������ֵ���Ӳ�Ȳ��켫��Z�ɷֱ���Y��W��R�γɼ��ֳ����Ķ�Ԫ����������������Ǵ�����Ⱦ�Rԭ��������Ӳ�����1�����ӡ�
(1) R2Z2�ĵ���ʽΪ___, Y��Z��W�ļ����Ӱ뾶�ɴ�С��˳��Ϊ______(�����ӷ��ţ���
(2) X��Z���γ�X2Z��X2Z3���ֲ����������廯���X2Zȼ������XZ2,д��X2Z��CuO��Ӧ�Ļ�ѧ����ʽ_____,X2Z3��ˮ��Ӧ���ɶ�Ԫ����(H2X2Z4),��X2Z3��NaOH��Һ��Ӧ�����ӷ���ʽΪ_______��
(3)Y2H4��һ�ֿ�ȼ��Һ�壬16.0 gY2H4����������ȫȼ������һ�ֵ�����Һ̬ˮʱ�ɷų�312kJ��������д��Y2H4ȼ�յ��Ȼ�ѧ����ʽ _______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���( )
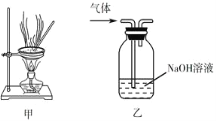
A.��pH��ֽ������ˮ��pH
B.��4.0 g NaOH��������100 mL����ƿ�У���ˮ���̶ȣ� ����1.000 mol��L1NaOH��Һ
C.��װ�ü�����Ũ��MgCl2��Һ������ȴ�ᾧ��MgCl2��6H2O����
D.��װ���ҳ�ȥ�����е�����HCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� Na2SO4��MgSO4��H2SO4 ����ˮ��� 0.2 L �����Һ����������Ũ����ͼ ��ʾ������˵�������( )
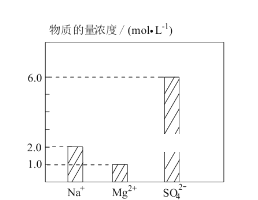
A. �û����Һ�� Na2SO4 �����ʵ���Ϊ 0.2 mol
B. �û����Һ�� H+�����ʵ���Ũ��Ϊ 8mol��L-1
C. �����û����Һ��ˮϡ�������Ϊ 1 L��ϡ�ͺ���Һ��SO42-�����ʵ���Ũ��Ϊ 1.2 mol��L-1
D. ����û����Һ����μ��� 2 mol��L-1NaOH ��Һ��Mg2+ǡ����ȫ�������� NaOH ��Һ 200 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�غ�ˮ����Ҫ���ӵĺ������±������������������������е���������ԭ����ͼ��ʾ(����Ϊ���Ե缫����Ĥֻ����������ͨ������Ĥֻ����������ͨ��)�������й�˵���������
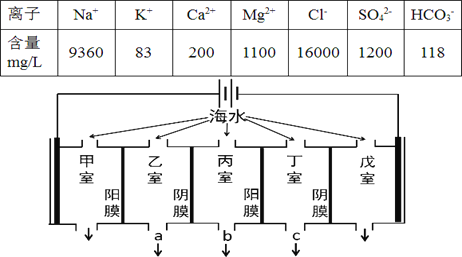
A. ���ҵĵ缫��ӦʽΪ��2Cl-��2e-= Cl2��
B. �������������������γ�ˮ��
C. ���ҺͶ����в������ӵ�Ũ������ˮ�ij���Ϊ b
D. �������ռ���22.4L(��״��)����ʱ��ͨ��������Ĥ�����ӵ����ʵ���һ��Ϊ2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25�桢101KPaʱ��agNH3��bgCH4�������ͬ��������������ȷ����
A.NH3��CH4�����ʵ���֮��Ϊa: b
B.NH3��CH4����������ܶ�֮��Ϊa: b
C.NH3��CH4��Ħ������֮��Ϊ17: 16
D.NH3��CH4�ķ�����֮��Ϊ1 : 1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com