
【题目】25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)或-1g[c(H+)/c(HC2O4-)]和-1gc(C2O42-)关系如图所示。下列说法不正确的是
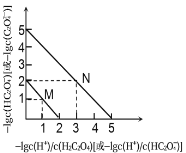
A. Ka1(H2C2O4)的数量级为10-2
B. 曲线M表示-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)的关系
C. 向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D. 在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
【答案】D
【解析】
本题主要考查电解质相关知识。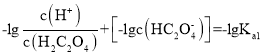 ,同理
,同理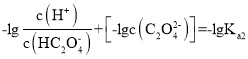 ,因
,因![]() ,故曲线M表示
,故曲线M表示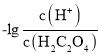 和
和![]() 的关系,曲线N表示
的关系,曲线N表示 和
和![]() 的关系,由此分析各选项正误。
的关系,由此分析各选项正误。
A. 由上述分析可知,曲线M表示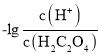 和
和![]() 的关系,Ka1=
的关系,Ka1=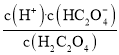 ,根据曲线M上的数值Ka1=10-1×10-1=10-2,曲线N表示
,根据曲线M上的数值Ka1=10-1×10-1=10-2,曲线N表示 和
和![]() 的关系,根据曲线N上的数值Ka2=
的关系,根据曲线N上的数值Ka2= =10-2×10-3=10-5,故A项正确;
=10-2×10-3=10-5,故A项正确;
B. 由上述分析可知,故曲线M表示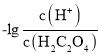 和
和![]() 的关系,故B项正确;
的关系,故B项正确;
C.当![]() 时,Ka2=
时,Ka2= =10-5,
=10-5,![]() ,故pH为5,C项正确;
,故pH为5,C项正确;
D.HC2O4-在溶液中既存在电离平衡又存在水解平衡,HC2O4-水解的离子方程式为HC2O4-+H2O![]() H2C2O4+OH-,HC2O4-水解平衡常数为
H2C2O4+OH-,HC2O4-水解平衡常数为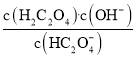 =Kw/Ka1=
=Kw/Ka1=![]() =1×10-12<Ka2,HC2O4-的电离程度大于水解程度,NaHC2O4溶液呈酸性,故
=1×10-12<Ka2,HC2O4-的电离程度大于水解程度,NaHC2O4溶液呈酸性,故![]() ,D项错误。
,D项错误。
答案选D。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1molL-1HA溶液中逐滴加入0.1molL-1NaOH溶液,混合溶液的pH随滴入NaOH溶液体积的变化如图所示。下列说法错误的是( )
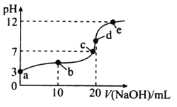
A.溶液导电性:e>d>c>b>a
B.水的电离程度:c>d>e>b>a
C.A-的水解常数:Kh≈10-9
D.b点溶液中存在![]() c(HA)=
c(HA)=![]() c(A-)+c(OH-)-c(H+)
c(A-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
A.反应正好达到平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_____(填离子符号),检验溶液中还存在Fe2+的方法是________________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为_________________。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_________。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.阴极增加的质量一定与阳极减少的质量相同
e. 利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图,下列说法中正确的是( )
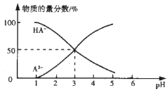
A.H2A的电离方程式为H2A=HA-+H+ HA-A2-+H+
B.室温下,Na2A水解平衡常数Kh=10-11
C.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)<0.1mol/L
D.常温下,等物质的量浓度NaHA与Na2A溶液等体积混合后溶液的pH=3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物。其部分合成工艺如下:
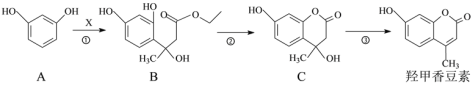
(1)已知![]() 不能稳定存在。反应①中X的分子式为C6H10O3,则X的结构简式为________。
不能稳定存在。反应①中X的分子式为C6H10O3,则X的结构简式为________。
(2)反应①、②的反应类型分别为________、________。
(3)下列有关说法正确的是________。
A.化合物B和C分子各含有1个手性碳原子
B.化合物C能发生加成反应、取代反应和消去反应
C.1 mol羟甲香豆素最多可与2 mol NaOH反应
(4)写出满足下列条件的化合物C的一种同分异构体的结构简式________。
①能发生水解反应,且水解产物之一能与FeCl3溶液发生显色反应;
②分子中只有2种不同化学环境的氢
(5)反应③的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:2HI(g)![]() H2(g)+ I2(g)△H> 0反应中各物质的浓度随时间变化情况如图1:
H2(g)+ I2(g)△H> 0反应中各物质的浓度随时间变化情况如图1:
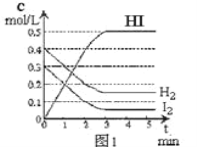
(1)该反应的化学平衡常数表达式为_________。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为_________
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K_________(填写增大、减小或不变)HI浓度的变化正确_________(用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是_________,(用图2中d-f的编号回答)
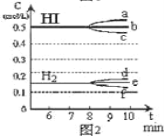
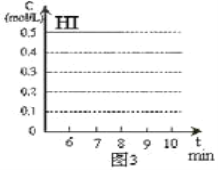
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com