
【题目】顺式乌头酸是一种重要的食用增味剂,其结构简式如图所示。下列有关说法错误的是( )
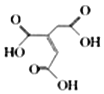
A.该有机物的分子式为:C6H6O6
B.该有机物分子中含有两种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.相同条件下,等量的顺式乌头酸分别与足量的NaHCO3、Na反应,产生气体的体积比为2:1
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近雾霾天气肆虐我国大部分地区。其中![]() 是造成空气污染的主要原因,利用钠碱循环法可除去
是造成空气污染的主要原因,利用钠碱循环法可除去![]() 。
。
![]() 钠碱循环法中,吸收液为
钠碱循环法中,吸收液为![]() 溶液中各离子浓度由大到小的顺序为_____________。
溶液中各离子浓度由大到小的顺序为_____________。
![]() 溶液吸收
溶液吸收![]() 反应的离子方程式是__________________________________。
反应的离子方程式是__________________________________。
![]() 已知
已知![]() 的电离常数为
的电离常数为![]() ,
,![]() ;
;![]() 的电离常数为
的电离常数为![]() ,
,![]() ,则下列微粒可以大量共存的是______
,则下列微粒可以大量共存的是______![]() 填序号
填序号![]() 。
。
A.![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 吸收液吸收
吸收液吸收![]() 的过程中,水溶液中
的过程中,水溶液中![]() 、
、![]() 、
、![]() 随pH的分布如图:
随pH的分布如图:

![]() 吸收
吸收![]() 制备
制备![]() 溶液,实验中确定何时停止通
溶液,实验中确定何时停止通![]() 的实验操作为_________________。
的实验操作为_________________。
![]() 在
在![]() 溶液中离子浓度关系不正确的是_______
溶液中离子浓度关系不正确的是_______![]() 填序号
填序号![]() 。
。
A.![]()
![]()
C.![]()
![]()
![]() 亚硫酰氯
亚硫酰氯![]() 又名氯化亚砜,是一种液态的非电解质,沸点为
又名氯化亚砜,是一种液态的非电解质,沸点为![]() 。
。![]() 中氯元素与硫元素直接以共价键相连,其中Cl呈
中氯元素与硫元素直接以共价键相连,其中Cl呈![]() 价;
价;![]() 遇水可生成
遇水可生成![]() 。请回答下列问题:蒸干
。请回答下列问题:蒸干![]() 溶液不能得到无水
溶液不能得到无水![]() ,若将
,若将 ![]() 与
与![]() 混合并加热,可制得无水
混合并加热,可制得无水![]() ,请用
,请用 ![]() 与水反应的方程式和必要的文字描述解释原因________________________________________________________。
与水反应的方程式和必要的文字描述解释原因________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸![]() 、亚砷酸
、亚砷酸![]() 是两种弱酸。回答下列问题:
是两种弱酸。回答下列问题:
(1)常温下,向![]() 溶液中滴加
溶液中滴加![]() 溶液,混合溶液中由水电离的
溶液,混合溶液中由水电离的![]() 与KOH溶液的体积之间的关系如图所示。
与KOH溶液的体积之间的关系如图所示。

![]() 点对应溶液的pH________
点对应溶液的pH________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() __________。
__________。
![]() 在一定温度下,向某容器中加入一定量的
在一定温度下,向某容器中加入一定量的![]() 、
、![]() 和NaOH溶液,发生反应:
和NaOH溶液,发生反应:![]() ,
,![]() 的转化率
的转化率![]() 与时间的关系如图所示,测得F点对应溶液中
与时间的关系如图所示,测得F点对应溶液中![]() 、
、![]() ,且溶液
,且溶液![]() 。
。

![]() 点:
点:![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;E点的
;E点的![]() ______G点的
______G点的![]() 。
。
![]() 下列情况表明该反应达到平衡状态的是__________
下列情况表明该反应达到平衡状态的是__________![]() 填字母
填字母![]() 。
。
![]()
![]() 溶液颜色不再变化
溶液颜色不再变化
![]() 溶液的pH不再变化
溶液的pH不再变化 ![]() 溶液中
溶液中 不再变化
不再变化
![]() 在该条件下,上述反应的平衡常数
在该条件下,上述反应的平衡常数![]() ____________
____________![]() 用含m的代数式表示
用含m的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]() H=-116kJ/mol在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
H=-116kJ/mol在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
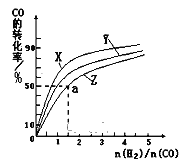
请回答:
①在上述三种温度中,曲线X对应的温度是___。
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数 K=___。
CH3OH(g)的平衡常数 K=___。
③下列既能提高上述反应中 CO 的平衡转化率,又能增大反应速率的是__(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
④若上述反应在某恒温恒容容器中发生,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变 b.△H保持不变
c.![]() 保持不变 d.气体密度保持不变
保持不变 d.气体密度保持不变
⑤在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol/L)变化如表所示:若5min~10min只改变了某一条件,所改变的条件是___。
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.合成肉桂酸甲酯的工业流程如图所示:
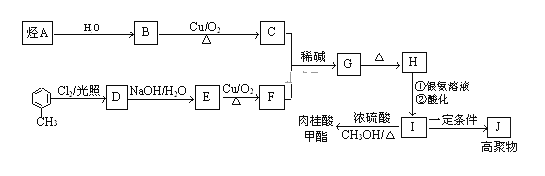
已知:I.醛与醛能发生反应,原理如下:![]() +CH3CHO
+CH3CHO RCH=CH2CHO
RCH=CH2CHO
Ⅱ.烃A在标准状况下的密度为1.25g/L。
请回答:
(1)化合物H中的官能团为__。
(2)A的结构简式为__,F的结构简式为__。
(3)G→H的反应类型为__。
(4)写出B→C的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量SiO2、Fe的氧化物)为原料制备碳酸镁晶体(MgCO33H2O)。实验过程如下:

下列说法不正确的是( )
A.为了加快酸溶速率,可将原料进行研磨并适当提高反应温度
B.滤渣的主要成分是H2SiO3和SiO2
C.萃取后,可用KSCN溶液检验水相中是否含有Fe3+
D.萃取后,往水溶液中加入适量的Na2CO3,经过加热蒸发,可得到碳酸镁晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是( )
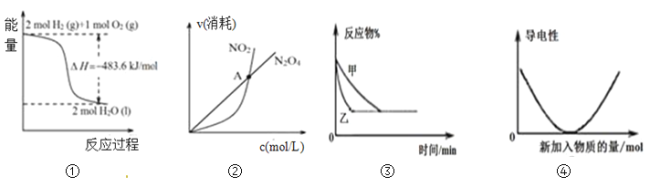
A.图①可知:热化学方程式是H2(g)+1/2O2(g)=H2O(g)△H=﹣241.8kJ/mol
B.图②可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.图③可表示:压强对2A(g)+2B(g)![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
D.图④可表示:Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com