
【题目】用粗制ZnO粉末(含杂质Fe、Ni等)制备高纯ZnO的流程如下:
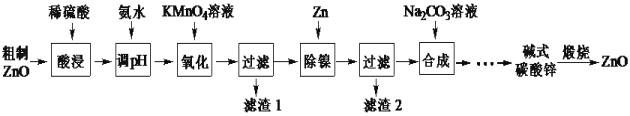
已知:本实验条件下,Ni2+不能被氧化,高锰酸钾还原产物为MnO2;过滤出滤渣1达到除铁目的。
(1)加快酸浸速率可采取的措施_____________________________。(任写一条)
(2)写出“除镍”步骤发生的主要反应离子方程式____________________________。
(3)“滤渣2”的成分是______。
(4)流程中“![]() ”涉及的操作有______、洗涤、______。
”涉及的操作有______、洗涤、______。
(5)获得的碱式碳酸锌需要用水洗涤,检验沉淀是否洗涤干净的方法是_____。
(6)若碱式碳酸锌的成分是ZnCO3· xZn(OH)2。取干燥后的碱式碳酸锌11.2g,煅烧后可得到产品8.1g,则x等于______。
【答案】适当升高温度或适当增大硫酸浓度 Zn+ Ni2+= Zn2++ Ni Ni、Zn 过滤 干燥 取少量最后一次洗涤液,加入盐酸酸化的BaCl2溶液,无白色沉淀产生,则洗涤干净 1
【解析】
(1)加快酸浸速率可采取的措施有:增大温度,增大反应的接触面积,提高酸的浓度等;
(2)根据此题需要制备的是氧化锌得出,除镍加入金属锌,发生置换反应;
(3)除镍后,得到镍以及过量的锌单质;
(4)省略的操作主要是过滤洗涤干燥冷却结晶;
(5)杂质主要有碳酸钠溶液,目的是检验碳酸根;
(6)根据煅烧后得到的产物是氧化锌来进行计算;
(1)加快酸浸速率可采取的措施有:增大温度,增大反应的接触面积,提高酸的浓度等,所以任写一条即可;
(2)根据此题需要制备的是氧化锌得出,除镍加入金属锌,不引入新的杂质,发生置换反应,方程式为Zn+ Ni2+= Zn2++ Ni;
(3)除镍时,为保证镍元素完全除去,需要加入过量的锌单质,所以得到的滤渣2有镍以及过量的锌单质;
(4)省略的操作主要是过滤洗涤干燥冷却结晶;
(5)杂质主要有碳酸钠溶液,目的是检验碳酸根,所以取少量最后一次洗涤液,加入盐酸酸化的BaCl2溶液,无白色沉淀产生,则洗涤干净;
(6)根据煅烧后得到的产物是氧化锌来进行计算,8.1g是氧化锌的质量,根据氧化锌的摩尔质量为81g/mol,推断出氧化锌有0.1mol,根据ZnCO3· xZn(OH)2分解可知消耗的质量主要是二氧化碳和水的质量,设二氧化碳有xmol,水有ymol,所以x+y=1mol,44x+18y=3.1g,解得x=0.05,y=0.05,所以根据比例,x=1;


科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,v(A)=________,v(B)=________。
(2)化学方程式中,x=________,y=________,p=________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是短周期元素,在周期表中的位置关系如图所示,下列说法不正确的是
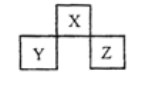
A.X、Z的原子序数之和与Y 的原子序数之比可能为5:3
B.X最简单的气态氢化物的稳定性一定高于Y的气态氢化物
C.Z单质的熔点一定高于Y单质
D.若Z的最高价氧化物为Z2O7,则Y的气态氢化物为YH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。下列说法不正确的是

A.M极的电极反应式为CH3—NH—NH2+12OH-10e![]() CO32-+N2↑+9H2O
CO32-+N2↑+9H2O
B.乙中的交换膜是阴离子交换膜,OH透过交换膜向M极移动
C.若忽略水的消耗与生成,甲中电解质溶液的pH减小,乙中电解质溶液的pH增大
D.理论上,标况下当生成6.72 L H2时,消耗CH3OCH3的质量为2.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
![]() 离子化合物含离子键,也可能含极性键或非极性键
离子化合物含离子键,也可能含极性键或非极性键
![]() 硫酸的酸性大于碳酸的酸性,所以非金属性
硫酸的酸性大于碳酸的酸性,所以非金属性![]()
![]() 含金属元素的化合物不一定是离子化合物
含金属元素的化合物不一定是离子化合物
![]() 由非金属元素组成的化合物一定是共价化合物
由非金属元素组成的化合物一定是共价化合物
![]() 熔融状态能导电的化合物是离子化合物
熔融状态能导电的化合物是离子化合物
![]() 由分子组成的物质中一定存在共价键
由分子组成的物质中一定存在共价键
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:

(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该铝热剂分别和100ml同物质的量浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定):
① | ② | ③ | ④ | |
铝热剂质量/g | 5g | 10g | 15g | 20g |
气体体积/L | 2.24L | 4.48L | 6.72L | 6.72L |
试完成下列计算:
(1)NaOH溶液的物质的量浓度_______________。
(2)该铝热剂中铝的质量分数_____________
(3)20g该铝热剂发生铝热反应理论上产生铁的质量是多少?________(写出步骤)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com