
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3 mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应初始时观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。

(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如上图所示,则试管b中反应的离子方程式为___________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
【答案】Al Mg+2H+=Mg2++H2↑ (1)
【解析】
根据镁、铝的活泼性比较与酸反应的快慢,通过实验现象判断反应物,并根据离子方程式的书写规则书写相关反应离子方程式。
(1)大小相同的镁片、铝片分别与相同浓度的盐酸反应时,二者反应的剧烈程度不同,镁活泼反应更剧烈,所以反应初始时产生气体较多,所以a中是镁,b中是铝,化学式为Al,故答案为:Al;
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,根据反应方程式计算得,铝产生的气体多,则试管b中是镁,镁和盐酸反应生成氯化镁和氢气,反应的离子方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(3)大小相同的镁片、铝片分别与相同浓度的盐酸反应时,二者反应的剧烈程度不同,可说明镁、铝金属性强弱的不同,但产生气体的多少不能说明镁、铝金属性的强弱,所以实验(2)不能说明镁的金属性强,故答案为:(1)。


科目:高中化学 来源: 题型:
【题目】氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。其合成反应原理是:C6H6+Cl2![]() C6H5Cl+HCl
C6H5Cl+HCl
某实验室制取氯苯的装置如图所示(加热和夹持装置已略去)。
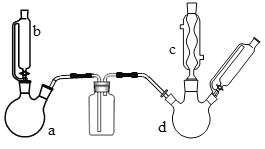
请回答下列问题:
(1)仪器a、b组合成制取氯气的装置,反应不需要加热,则仪器a中的固体反应物是__(填化学式)。
(2)把氯气干燥后通入装有40mL苯(密度0.88g/mL)的反应器d中(内有铁屑作催化剂),维持反应温度在50~60℃,回流40分钟。对仪器d加热的方法是__。
(3)仪器c的名称是___,仪器c出口的气体成分有HCl、Cl2和__。
(4)将d中的液体倒入分液漏斗中,分别用蒸馏水和NaOH溶液洗涤,分离出的产物干燥后,进行蒸馏纯化,得到24g纯净的氯苯。
①碱洗之前要进行水洗,其目的是__。
②用10%NaOH溶液碱洗时发生氧化还原反应的化学方程式为__。
③该实验所得氯苯的产率为__(保留小数点后一位),该产率低于理论产率的原因___(填写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() .
.
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________.
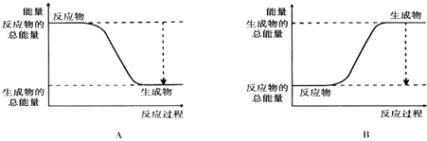
(3)从断键和成键的角度分析上述反应中能量的变化.
化学键 |
|
|
|
键能 |
|
|
|
请填写下表:
化学键 | 填“吸收”或“放出”能量 | 能量变化 | |
拆开化学键 |
| ①________ | ④________ |
| |||
形成化学键 |
| ②________ | ⑤________ |
总能量变化 | ③________ | ⑥________ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、![]() 溶液,所得沉淀溶解平衡图像如图所示(不考虑
溶液,所得沉淀溶解平衡图像如图所示(不考虑![]() 的水解)。下列叙述不正确的是( )
的水解)。下列叙述不正确的是( )
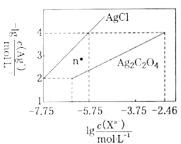
A.n点表示![]() 的不饱和溶液
的不饱和溶液
B.![]() 的值等于10-9.75
的值等于10-9.75
C.![]() 的平衡常数为109.04
的平衡常数为109.04
D.向![]() 的混合液中滴入AgNO3溶液时,先生成
的混合液中滴入AgNO3溶液时,先生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
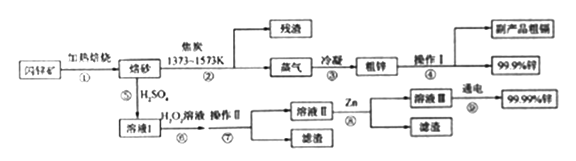
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某些短周期元素的性质或原子结构信息如表所示。
元素 | 元素性质或原子结构信息 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下的单质为双原子分子,其简单氢化物的水溶液呈碱性 |
Z | 元素的最高正价是+7 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______。
(2)元素Y与氢元素能形成两种常见的10电子微粒,且在一定条件下,其中一种微粒与OH反应可以转化为另一种微粒,该反应的离子方程式为_________________。
(3)元素Z与元素T相比,非金属性较强的是______(填元素符号),下列表述能证明这一事实的是_______(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的简单氢化物比T的简单氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____(填对应酸的化学式),理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断正确的是
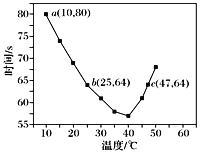
A.40 ℃之前,温度升高反应速率减慢,变蓝时间变长
B.40 ℃之后溶液变蓝的时间随温度的升高变短
C.图中b、c两点对应的NaHSO3的反应速率相等
D.图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
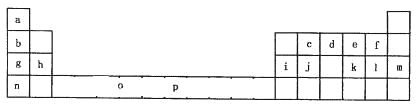
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或装置,不能达到实验目的的是( )。

A.图Ⅰ用于实验室制氨气并收集干燥的氨气
B.图Ⅱ用于检验浓硫酸与铜反应后的产物中是否含有铜离子
C.图Ⅲ用于验证牺牲阳极的阴极保护法
D.图Ⅳ用于制取![]() 晶体
晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com