
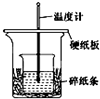
 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )| A、如图条件下实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是固定小烧杯 |
| D、若改用60 mL 0.50 mol/L盐酸跟60 mL 0.50 mol/L的NaOH溶液进行反应,所放出热量相等 |


科目:高中化学 来源: 题型:
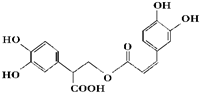
| A、迷迭香酸属于芳香烃 |
| B、1mol迷迭香酸最多能和含6mol NaOH的水溶液完全 |
| C、迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D、1mol迷迭香酸最多能和9mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

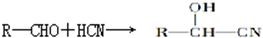 ,②R-CN
,②R-CN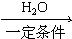 R-COOH
R-COOH 制备高分子化合物
制备高分子化合物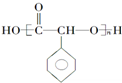 的合成路线流程图
的合成路线流程图
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | A | B | C |
| 反应物投入量 | 1molCO2(g)和 3molH2(g) | 1molCH3OH(g)和 1molH2O(g) | 2molCO2(g)和6mol H2(g) |
| CH3OH(g)浓度(mol/L) | c1 | c2 | c3 |
| 反应能量变化 | 放出29.4kJ | 吸收a kJ | 放出b kJ |
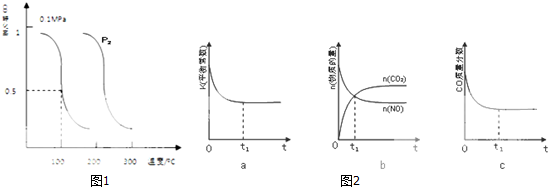
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠固体(碳酸钠):加热固体混合物使之分解 |
| B、铁粉(铝):加入足量稀盐酸,充分反应后过滤、洗涤、干燥 |
| C、硫酸亚铁溶液(硫酸铁):加入足量铁屑,充分反应后过滤 |
| D、二氧化碳(氯化氢):依次通过盛有氢氧化钠溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
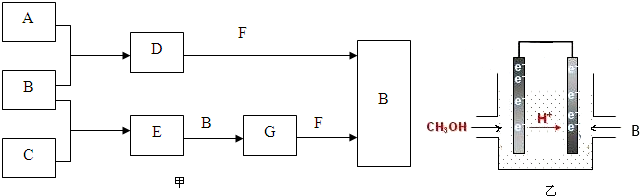
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖可以转变成脂肪,储存在脂肪组织中,过多食用糖类容易使人发胖 |
| B、某些植物油和鱼油中的不饱和甘油酯含量丰富,而动物脂肪中饱和甘油酯含量很高 |
| C、蛋白质溶液遇到浓的硫酸铵、硫酸钠等无机盐溶液,会析出沉淀,这个过程称为变性 |
| D、人体对维生素的需求量很小,但是,人类的生命活动不可缺少它 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com