随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO
2、CH
4、CH
3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
Ⅰ、热化学方程式为:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B | C |
| 反应物投入量 | 1molCO2(g)和
3molH2(g) | 1molCH3OH(g)和
1molH2O(g) | 2molCO2(g)和6mol H2(g) |
| CH3OH(g)浓度(mol/L) | c1 | c2 | c3 |
| 反应能量变化 | 放出29.4kJ | 吸收a kJ | 放出b kJ |
①从反应开始到达平衡时,A中用CO
2来表示的平均反应速率为
mol/(L?s)(用具体数值表示)
②a=
.c
1
c
2
1/2c
3(填“>”“<”或“=”).
Ⅱ、CO可用于合成甲醇.在压强0.1MPa条件下,向体积为bL的密闭容器中充入amolCO和2amolH
2,在催化剂作用下合成甲醇:CO(g)+2H
2(g)?CH
3OH(g).平衡时CO的转化率与温度、压强的关系如图1所示
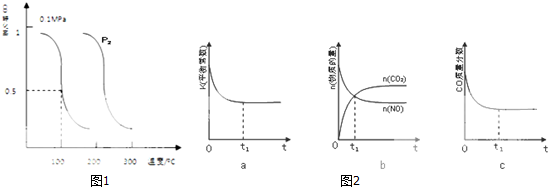
(1)该反应属于反应
(填“吸热”或“放热”);P
2
0.1MPa(填“>”“<”或“=”)
(2)100℃时,该反应的平衡常数K=
(用含a、b的代数式表示)
Ⅲ、碳一化合物在治理汽车尾气方面也大有可为,如CO、CH
4等在一定条件下均可以与氮氧化物生成无污染的物质.CO与NO在催化剂的条件下反应如下:2NO(g)+2CO(g)?2CO
2(g)+N
2(g)△H<0,在绝热、恒容的密闭容器中加入一定量的NO和CO发生上述反应,图2的示意图不能说明反应在进行到t
1时刻达到平衡状态的是
(填字母序号)




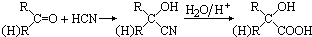 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成: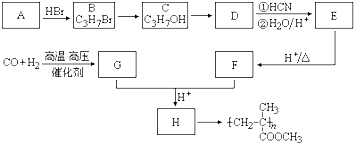
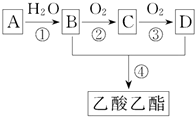 一股淡淡清香能给人心旷神怡的感觉,主要由香精、酒精和水构成的香水备受爱美人士的青睐.香精里面含有酯类物质,工业上以A为主要原料来合成乙酸乙酯,其合成路线如图所示.其中A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.又知
一股淡淡清香能给人心旷神怡的感觉,主要由香精、酒精和水构成的香水备受爱美人士的青睐.香精里面含有酯类物质,工业上以A为主要原料来合成乙酸乙酯,其合成路线如图所示.其中A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.又知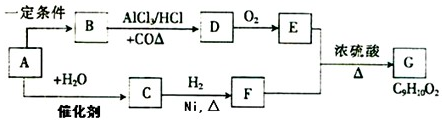
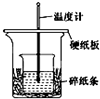 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )