
| A、②③④⑤⑥ | B、①②③④⑤ |
| C、②③④⑤ | D、全部 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

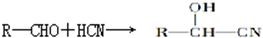 ,②R-CN
,②R-CN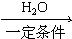 R-COOH
R-COOH 制备高分子化合物
制备高分子化合物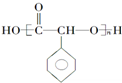 的合成路线流程图
的合成路线流程图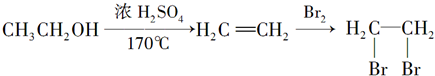
查看答案和解析>>
科目:高中化学 来源: 题型:
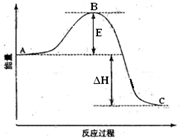
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | A | B | C |
| 反应物投入量 | 1molCO2(g)和 3molH2(g) | 1molCH3OH(g)和 1molH2O(g) | 2molCO2(g)和6mol H2(g) |
| CH3OH(g)浓度(mol/L) | c1 | c2 | c3 |
| 反应能量变化 | 放出29.4kJ | 吸收a kJ | 放出b kJ |
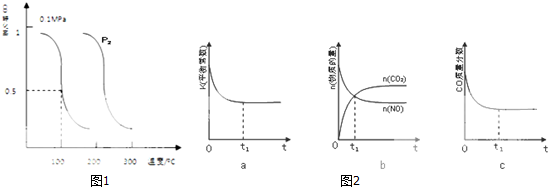
查看答案和解析>>
科目:高中化学 来源: 题型:
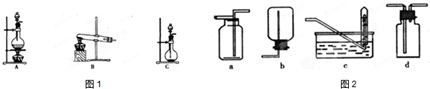
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠固体(碳酸钠):加热固体混合物使之分解 |
| B、铁粉(铝):加入足量稀盐酸,充分反应后过滤、洗涤、干燥 |
| C、硫酸亚铁溶液(硫酸铁):加入足量铁屑,充分反应后过滤 |
| D、二氧化碳(氯化氢):依次通过盛有氢氧化钠溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com