
【题目】对室温下氢离子浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施,
有关叙述正确的是( )
A.加适量的CH3COONa晶体,两溶液的氢离子浓度减小
B.使温度升高20 ℃,两溶液的氢离子浓度不变
C.加水稀释2倍,两溶液的氢离子浓度增大
D.加足量的Zn充分反应后,两溶液中产生的氢气一样多
【答案】A
【解析】
A.醋酸和盐酸的c(H+)相同,CH3COOH溶液中存在着电离平衡:CH3COOH![]() CH3COO-+H+,加入少量CH3COONa晶体,平衡向逆反应方向移动,溶液中c(H+)减小。而盐酸则和CH3COONa反应生成弱电解质CH3COOH,c(H+)减小,故A正确;
CH3COO-+H+,加入少量CH3COONa晶体,平衡向逆反应方向移动,溶液中c(H+)减小。而盐酸则和CH3COONa反应生成弱电解质CH3COOH,c(H+)减小,故A正确;
B.升温,促进CH3COOH电离,c(H+)增大,盐酸挥发,溶质减少,c(H+)减小,故B错误;
C.加水稀释,CH3COOH的电离平衡向正反应方向移动,稀释相同倍数后两溶液的c(H+)不相同,醋酸中的c(H+)大于盐酸中的c(H+),但c(H+)均减小,故C错误;
D.由于醋酸和盐酸的c(H+)相同,而醋酸为弱酸,所以c(CH3COOH)大于c(HCl),加入足量的锌,由于两溶液体积相同,CH3COOH的量大于HCl的量,因此醋酸产生的氢气多,故D错误;
故答案选A。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】常温下,实验测得![]() 溶液
溶液![]() ,平衡时碳的分布系数
,平衡时碳的分布系数![]() 各含碳微粒的浓度占含碳各种微粒浓度之和的分数
各含碳微粒的浓度占含碳各种微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是
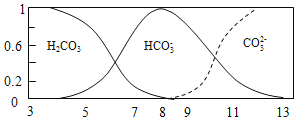
A.常温下,![]()
B.![]() 时,溶液中不存在
时,溶液中不存在![]() 的水解平衡
的水解平衡
C.pH由![]() 时,随着pH值的增大,
时,随着pH值的增大,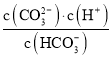 增大
增大
D.![]() 时,有
时,有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,碳酸(H2CO3)的电离常数Ka1=4.5×10-7、Ka2=5.0×10-11。常温下,向20mL0.1molL-1Na2CO3溶液中逐滴加入0.1molL-1的盐酸40mL,溶液中含碳元素各微粒(CO2因逸出未画出)的物质的量分数随溶液pH的变化如图所示,下列说法错误的是( )

A.随着盐酸的加入,溶液中![]() 的值增大
的值增大
B.加入盐酸至溶液pH=8的过程中,水的电离程度逐渐减小
C.当pH=7时,溶液中c(Na+)>c(HCO3-)>cCl-)
D.当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)![]() 2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
(1)求该反应的平衡常数____。
(2)求平衡时A的转化率____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N(均为气体)的物质的量随反应时间变化的曲线如图,如图所示:

(1)该反应的化学方程式是__________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,t2时刻V(生成M)____V(消耗M)(填>、<或=);
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列叙述正确的是![]()
A.![]() 的
的![]() 与
与![]() 混合溶液中
混合溶液中![]()
B.![]() 的可乐中
的可乐中![]() 是
是![]() 的柠檬水中
的柠檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀释至100mL,pH和
溶液加水稀释至100mL,pH和![]() 均减小
均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿![]() 主要成分为
主要成分为![]() 生产高锰酸钾产生的锰泥中,还含有
生产高锰酸钾产生的锰泥中,还含有![]() 的
的![]() 、
、![]() 的
的![]() 均为质量分数
均为质量分数![]() ,及少量Cu、Pb的化合物等,用锰泥可回收制取
,及少量Cu、Pb的化合物等,用锰泥可回收制取![]() ,过程如图:
,过程如图:
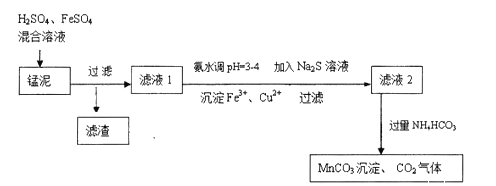
![]() 高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
![]() 除去滤液1中
除去滤液1中![]() 的离子方程式是 ______ .
的离子方程式是 ______ .
![]() 经实验证明:
经实验证明:![]() 稍过量时,起始
稍过量时,起始![]() 、
、![]() 混合溶液中
混合溶液中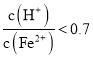 时,滤液1中能够检验出有
时,滤液1中能够检验出有![]() ;
;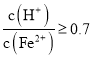 时,滤液1中不能检验出有
时,滤液1中不能检验出有![]() 根据上述信息回答①②③:
根据上述信息回答①②③:
①检验![]() 是否氧化完全的实验操作是 ______ .
是否氧化完全的实验操作是 ______ .
②生产时![]() 、
、![]() 混合溶液中
混合溶液中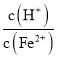 应控制在
应控制在![]() 之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
③若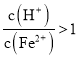 ,调节
,调节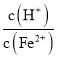 到
到![]() 的最理想试剂是 ______
的最理想试剂是 ______ ![]() 填序号
填序号![]()
![]() 溶液
溶液 ![]() 铁粉
铁粉 ![]()
![]() 写出滤液2中加入过量
写出滤液2中加入过量![]() 反应的离子方程式: ______ .
反应的离子方程式: ______ .
![]() 上述过程锰回收率可达
上述过程锰回收率可达![]() ,若处理1740kg的锰泥,可生产
,若处理1740kg的锰泥,可生产![]() ______ kg.
______ kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2g;又通过碱石灰时,碱石灰的质量增加了 17.6g。该有机物的化学式是
A. C2H4 B. C2H6O C. C2H6O2 D. C3H6O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com