
【题目】如表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ③能与水在一定条件下反应生成有机物C |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③在Cu作催化剂且加热条件下能与O2反应 |
D | ①由C、H、O三种元素组成;②球棍模型为 ③能与C反应生成相对分子质量为100的酯 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是___。
(2)B具有的性质是____(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色。
(3)由B制备硝基苯的化学方程式____。
(4)D与C反应能生成相对分子质量为100的酯,该反应的反应类型为___;其化学方程式为____。
【答案】1,2-二溴乙烷 ②③⑦ ![]() +HO-NO2
+HO-NO2![]()
![]() +H2O 酯化反应(或取代反应) CH2=CH-COOH+CH3CH2OH
+H2O 酯化反应(或取代反应) CH2=CH-COOH+CH3CH2OH![]() CH2=CH-COOCH2CH3+H2O
CH2=CH-COOCH2CH3+H2O
【解析】
A能使溴的四氯化碳溶液褪色,含有不饱和键,结合比例模型可知A为CH2=CH2;B由C、H两种元素组成,由球棍模型模型,可知B为![]() ;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,可以由乙烯与水反应得到,则C为CH3CH2OH;D由C、H、O三种元素组成,结合D的球棍模型,可知D为CH2=CH-COOH;乙醇能与D反应生成相对分子质量为100的酯E,则E为CH2=CH-COOCH2CH3,以此解答。
;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,可以由乙烯与水反应得到,则C为CH3CH2OH;D由C、H、O三种元素组成,结合D的球棍模型,可知D为CH2=CH-COOH;乙醇能与D反应生成相对分子质量为100的酯E,则E为CH2=CH-COOCH2CH3,以此解答。
根据上述分析可知:A是CH2=CH2;B为![]() ;C为CH3CH2OH;D为CH2=CH-COOH;E为CH2=CH-COOCH2CH3。
;C为CH3CH2OH;D为CH2=CH-COOH;E为CH2=CH-COOCH2CH3。
(1)A为乙烯,A与Br2的CCl4溶液反应的生成物是CH2Br-CH2Br,该物质的名称是1,2-二溴乙烷;
(2)B是苯,苯是无色有特殊气味的液体,有毒,不溶于水,且密度小于水,与酸性高锰酸钾溶液和溴水都不反应,在一定条件下能和氢气发生加成反应生成环己烷,能与溴水发生萃取作用,因此苯与溴水混合后液体分层,由于苯的密度比水小,且与水互不相容,因此会看到液体分层,且上层呈橙红色。故合理选项序号为②③⑦;
(3)在浓硫酸存在和加热条件用下,苯和浓硝酸发生取代反应生成硝基苯,反应方程式为:![]() +HO-NO2
+HO-NO2![]()
![]() +H2O;
+H2O;
(4)C为CH3CH2OH,D为CH2=CH-COOH,二者在浓硫酸存在和加热条件下发生酯化反应生成相对分子质量为100的酯E为 CH2=CH-COOCH2CH3,反应类型为酯化反应,也属于取代反应酯化反应与酯的水解反应互为可逆反应,故该反应方程式为CH2=CH-COOH+CH3CH2OH![]() CH2=CH-COOCH2CH3+H2O。
CH2=CH-COOCH2CH3+H2O。


科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:
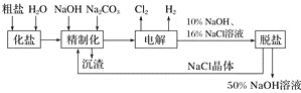
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
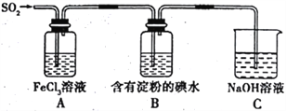
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、硫、氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。
(1)氯气的颜色____________________。
(2)浓硫酸具有:①酸性,②强氧化性,③吸水性,④脱水性,下列各现象硫酸所表现出的性质为(填序号):
干燥氯气 ___________ ,使蔗糖变黑 ___________,
吸收氨气 ___________ ,与铜反应____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
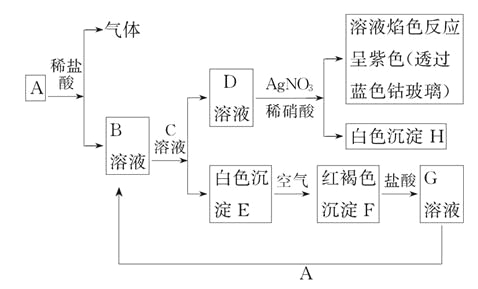
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)![]() pC(g)+qD(g)。
pC(g)+qD(g)。
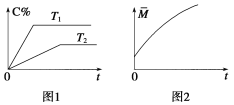
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质________mol。
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图1所示。则T1(填“>”、“<”或“=”)______T2,该反应正反应方向的ΔH(填“>”、“<”或“=”)______0。
(3)一定条件下,从正反应开始至达到化学平衡的过程中,混合气体的平均相对分子质量随时间的变化如图2所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)__________。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是

A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)8.5g氢氧根离子含有的电子数目为_______。
(2)3.1gNa2X含有Na0.1mol,则Na2X的摩尔质量为______,X的相对原子质量为_______。
(3)若1gCO2中含有x个原子,则阿伏加德罗常数可表示为_______。
(4)由硫酸钾、 硫酸铁和硫酸组成的混合溶液,其中c(H)0.1mol/L,c(Fe3)0.3mol/L,c(SO42)0.6mol/L,则c(K)为_______。
(5)相同物质的质量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1时,消耗三种盐溶液的体积比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com