
����Ŀ�����仯������������������������Ҫ��Ӧ�ü�ֵ���밴Ҫ��ش��������⡣
��1����ͼ��ͨ���Ȼ�ѧѭ���ڽϵ��¶�����ˮ������ֽ��Ʊ������ķ�Ӧϵͳԭ��.

ͨ�����㣬��֪ϵͳ(��)��ϵͳ(��) ������Ȼ�ѧ����ʽ�ֱ�Ϊ_________��_________���Ƶõ���H2�����������ٵ���ϵ�y_________��
��2��H2S ��CO2�ڸ����·�����Ӧ: H2S(g)+CO2(g) ![]() COS(g)+H2O(g)����340��ʱ����0.10molCO2��0.10molH2S����2.5 L�Ŀո�ƿ�С�
COS(g)+H2O(g)����340��ʱ����0.10molCO2��0.10molH2S����2.5 L�Ŀո�ƿ�С�
�ٸ÷�Ӧƽ���H2O(g)�����ʵ�������Ϊ0.3��H2S��ƽ��ת������1=____����Ӧƽ�ⳣ��K=____��
����350���ظ����飬ƽ���H2O(g)�����ʵ�������Ϊ0.4��H2S��ת������2_____��1��(����>����<������=��)�÷�Ӧ�ġ�H____0��
�۲ⶨ����������: �������е���ת��ΪH2SO3,Ȼ����һ��Ũ�ȵ�I2��Һ���еζ�������ָʾ��Ϊ____���ζ���Ӧ�����ӷ���ʽΪ__________��
��֪25 ��ʱ��H2SO3�ĵ��볣��K.a1=1��10-2,Ka2=5��10-8,����¶���NaHSO3��ˮ��ƽ�ⳣ��Kb=_____������NaHSO3��Һ�м���������I2,����Һ��c(H2SO3)/c(HSO3-)��_______(����������������С����������" ).
���𰸡� H2O(1)=H2(g)+1/2O2(g) ��H=+286kJ/mol H2S(g)=H2(g)+S(s) ��H=+20kJ/mol (II) 60% 2.25 > > ������Һ H2SO3+I2+H2O=4H++SO42-+2I- 1.0��10-12 ����
����������1����ϵͳ(��)����������ʽ����������ó�ˮ�ֽ��Ʊ��������Ȼ�ѧ����ʽ����������Ӧ����H����ȷ����H2O(1)=H2(g)+1/2O2(g) ��H=+286kJ/mol����ϵͳ(��)�������Ȼ�ѧ����ʽ����������ó�����ֽ��Ʊ��������Ȼ�ѧ����ʽ����������Ӧ����H����ȷ����H2S(g)=H2(g)+S(s) ��H=+20kJ/mol ��
��2���������֪��c(CO2)=0.04mol/L�� c(H2S)=0.04mol/L��
H2S(g) + CO2(g) ![]() COS(g)+H2O(g)
COS(g)+H2O(g)
��ʼŨ�� 0.04 0.04 0 0
�仯Ũ�� x x x x
ƽ��Ũ�� 0.04- x 0.04- x x x
��Ӧƽ���H2O(g)�����ʵ�������Ϊ0.3����x����x+ x+0.04- x+0.04- x��=0.3��x=0.024 mol/L��H2S��ƽ��ת������1=0.024��0.04��100%= 60% ��
ƽ�ⳣ��K= x2/(0.04- x)2=0.0242/0.0162=2.25��
�۵�������ˮ��Һ���������õ�����ָʾ�����ⵥ�ʰ�����������Ϊ���ᣬ������ԭΪ�����ӣ���ȷ�𰸣�������Һ�� H2SO3+I2+H2O=4H++SO42-+2I- ��
������Ϊ��Ԫ���ᣬ����������: H2SO3 ![]() H++HSO3- K.a1��HSO3-
H++HSO3- K.a1��HSO3-![]() H++SO32- Ka2��
H++SO32- Ka2��
NaHSO3��ˮ��ƽ�⣺HSO3-+H2OH2SO3+OH-��ƽ�ⳣ��=c(H2SO3)c(OH-)/c(HSO3-);����ƽ�⣺
H2SO3 ![]() H++HSO3- K.a1=c(H+)c(HSO3-)/c(H2SO3),����ʽ�����������ˮ��ƽ�ⳣ��=KW/ K.a1=1��10-14/1��10-2=10-12����NaHSO3��Һ�м���������I2�������ᣨ�����ᣩ������ǿ�ᣨ���ᡢ����ᣩ����Һ������ǿ��c(H+)�������¶Ȳ��䣬KW��Kh����������ˮ��ƽ�ⳣ�����㹫ʽ��Kh= c(H2SO3)c(OH-)/c(HSO3-)��c(H+)c(OH-)=KW �������ΪKh= c(H2SO3) KW/ c(HSO3-)c(H+)�����ԣ�c(H2SO3)/c(HSO3-)������ȷ����10-12��������
H++HSO3- K.a1=c(H+)c(HSO3-)/c(H2SO3),����ʽ�����������ˮ��ƽ�ⳣ��=KW/ K.a1=1��10-14/1��10-2=10-12����NaHSO3��Һ�м���������I2�������ᣨ�����ᣩ������ǿ�ᣨ���ᡢ����ᣩ����Һ������ǿ��c(H+)�������¶Ȳ��䣬KW��Kh����������ˮ��ƽ�ⳣ�����㹫ʽ��Kh= c(H2SO3)c(OH-)/c(HSO3-)��c(H+)c(OH-)=KW �������ΪKh= c(H2SO3) KW/ c(HSO3-)c(H+)�����ԣ�c(H2SO3)/c(HSO3-)������ȷ����10-12��������


 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����������ܱ������зֱ�������������Ӧ����H2(g)+I2(g) ![]() 2HI(g) ��C(s)+H2O(g)
2HI(g) ��C(s)+H2O(g) ![]() CO(g)+H2(g)������״̬�ܱ�������Ӧ���ﵽƽ��״̬����( )
CO(g)+H2(g)������״̬�ܱ�������Ӧ���ﵽƽ��״̬����( )
a�������ʵ�Ũ�Ȳ���
b������������ѹǿ����
c�������������ܶȲ���
d��������������ɫ����
e������ֵ����ʵ���������������������
A.abc
B.ade
C.ac
D.ae
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������в����У�һ������²�����Ӵ�����(����)
A.����ʱ����������������ֽ
B.����Ͳ��ʳ����Һ������4.3 mL��Һ
C.����ʱ���ձ��ڱ���©���¶�
D.�ý�ͷ�ι����Թ��ڵμ�Һ��ʱ����ͷ�ιܼ�����Թ��ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦmA(g)��nB(g) ![]() pC(g)�ﵽƽ��������¶ȣ�B��ת���ʱ����Сѹǿ��C�����������С��
pC(g)�ﵽƽ��������¶ȣ�B��ת���ʱ����Сѹǿ��C�����������С��
(1)����>��������������<����գ��÷�Ӧ����H______0��m��n______p��
(2)��������������С���������������(������������)�������¼���B����A��ת����________�������¶ȣ���ƽ��ʱB��C��Ũ��֮��c(B)/c(C)��________�����������ƽ��ʱ��������������ʵ���________��
(3)��A��C��Ϊ��ɫ���壬BΪ��ɫ���壬����������������dz��������������գ������¼���C��ƽ���������ɫ________������ѹ����������ƽ��������ɫ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��:Ba(OH)2�����壩��CuSO4�����壩��CH3COOH��Һ̬����Щ����Ϊʲô��Ϊһ�࣬������Щ���ʻ����Ժ����ǹ�Ϊһ��
A.75%�ľƾ���Һ
B.�����
C.Al(OH)3����
D.ţ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б������ʻ��Լ��ķ�������ȷ����
A.ʵ���ұ�����ʱ�����ڱ���Һ����Լ�ƿ�м�������ˮ����ֹ��ӷ�
B.ʢ����ˮ���Լ�ƿ����������
C.������ˮӦ�ܷⱣ������ɫ�Լ�ƿ��
D.ȡ��ˮ���Թ��У�����CCl4�����ã���Һ�ֲ㣬�ϲ���Ϻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���и���Ԫ����A,B��Ԫ�ص�ԭ�����������п��γ�AB2�����ӻ�������ǣ� ��
��6��8 ��12��17 ��20��9 ��11��17��
A.�٢�
B.�٢�
C.�ڢ�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0 L�����ܱ������з���0.10 mol X����һ���¶��·�����Ӧ��X(g)![]() Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ����( )
Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ����( )
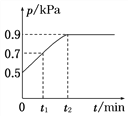
A. ���¶��´˷�Ӧ��ƽ�ⳣ��K��3.2
B. �ӷ�Ӧ��ʼ��t1ʱ��ƽ����Ӧ����v(X)��![]() mol��L��1��min��1
mol��L��1��min��1
C. �����ƽ����ϵ��Y�İٷֺ������ɼ���һ������X
D. �����������䣬�ٳ���0.1 mol����X��ƽ�������ƶ���X��ת���ʼ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com