
【题目】铝是一种应用广泛的金属。某兴趣小组对金属铝展开了系列研究。
I.研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为______。实验前,需要对铝的表面先进行______(填操作)处理。兴趣小组同学将铝处理好后剪成若干大小相同的小片,用于后续实验。
(2)铝和酸、碱、盐溶液的反应
实验 | 操作 | 现象 | 结论 |
一 | 将铝片放入稀盐酸中 | ,试管变烫 | 铝能与盐酸发生反应,反应放热 |
二 | 将铝片放入氢氧化钠溶液中 | 铝表面有气泡产生试管变烫 | 铝能与氢氧化钠溶液反应,反应放热 |
三 | 将铝放入硫酸铜溶液中 | 铝表面有红色物质产生,溶液逐渐变成无色 | 金属活动性:铝 铜 |
实验一的现象为_____。
实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为____。实验三表明,铝的金属活动性____(填“大于“或”小于“)铜。
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内发现铝片表面产生的气泡较少,反应较慢。对比上述两组实验产生猜想。猜想①:稀盐酸中的氯离子对反应可能有促进作用。猜想②:____。为验证猜想①是否合理,应在铝和稀硫酸中加入____(填字母),观察现象。
A.Na2SO4 B.Na2CO3 C.NaCl
II.测定某铝样品中金属铝的质量分数
(资料1)氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
(资料2)AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl。
(4)小组同学称取4.62g某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加入足量稀盐酸至完全反应。将反应后的液体分成溶液1和溶液2两等份,设计两种实验方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。

①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程)。_____。
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是_____。
【答案】4Al+3O2=2Al2O3 打磨 产生气泡 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 大于 稀硫酸中的硫酸根离子对反应可能有抑制作用 C 77.9% 反应放热,导致瓶内气体体积膨胀,排出的水偏多
【解析】
(1)铝和氧气在常温下反应生成氧化铝,方程式为4Al+3O2=2Al2O3,因此实验前,需要对铝的表面先进行打磨处理;
(2)铝的活泼性比较强,故实验一的现象为铝表面有气泡产生,铝和氢氧化钠、水反应生成偏铝酸钠和氢气,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,实验三铝能置换出铜,这说明铝的活泼性大于铜;
(3)两种溶液中阴离子不同,则猜想②:稀硫酸中的硫酸根离子对反应可能有抑制作用,为验证猜想①是否合理,应在铝和稀硫酸中加入NaCl,观察现象;
(4)①氢氧化钠过量不可能形成氢氧化铝沉淀,方案1不正确;整个样品中铝元素的质量![]() ,整个样品中氧化铝的质量
,整个样品中氧化铝的质量![]() ,整个样品种的铝的质量
,整个样品种的铝的质量![]() ,样品中金属铝的质量分数
,样品中金属铝的质量分数![]() ;
;
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积,计算后发现金属铝的质量分数偏大,可能的原因是反应放热,导致瓶内气体体积膨胀,排出的水偏多。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应①:O3![]() O2+[O] ΔH>0 平衡常数为K1;
O2+[O] ΔH>0 平衡常数为K1;
反应②: [O]+O3![]() 2O2 ΔH<0 平衡常数为K2;
2O2 ΔH<0 平衡常数为K2;
总反应: 2O3![]() 3O2 ΔH<0 平衡常数为K。
3O2 ΔH<0 平衡常数为K。
下列叙述正确的是( )
A. 降低温度,K减小 B. K=K1+K2
C. 适当升温,可提高消毒效率 D. 压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO3- >I2 |
B | 淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸 | 无红色沉淀生成 | 淀粉没有水解 |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数:Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取5 mL 0.1 mol/L 酸性KMnO4溶液,分别加入0.1 mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2 mol/L H2C2O4溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。
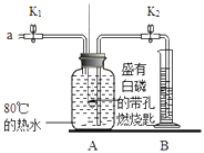
(实验)
①检查装置的气密性,气密性良好。
②向A瓶中加满80℃热水,将盛有白磷的带孔燃烧匙快速浸没热水中,塞紧瓶塞,白磷不燃烧。
③打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧。
(1)对比步骤②和③的现象可知,可燃物燃烧的条件之一是___;白磷燃烧的反应方程式为_____。
(2)待装置冷却一段时间后,打开K2,如果观察到____,说明空气中氧气的体积约占1/5。如何确定此装置气密性良好?(忽略燃烧匙位置漏气情况)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
B. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
C. 恒温下向溶液中加入CaO,溶液的pH升高
D. 给溶液加热,溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 根据一次能源和二次能源的划分,氢气为二次能源
B. 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C. 火力发电是将燃料中的化学能直接转化为电能的过程
D. 在火力发电过程中,化学能转化为热能实际上是氧化还原反应发生的过程,伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、CH3OH既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0 mol CH4和2.0 mol H2O(g) 通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
(2)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g) ![]() CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________(填选项序号)。
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________(填选项序号)。
a.消耗1 mol CO2同时生成1 mol CH3OH b.容器内压强保持不变
c.混合气体的密度保持不变 d.CH3OH(g)的浓度保持不变
(4)以KOH为电解质的甲醇-空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。 回答下列问题:

①该原电池的正极是____(填“甲”或“乙”),电解过程中乙电极附近pH____(填“增大”或“减小”);
②负极的电极反应式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com